Evaluación inicial de los nódulos tiroideos
Esquema clínico
= Primers en tiroidología
= Presentación del Journal Club
= Discusión basada en casos (incluyendo mesas redondas)
= Conferencias de Gran Ronda
Resumen de Guías de Práctica Clínica
1. Antecedentes clínicos
A. Historial médico anterior1-3
ATA // AACE // JAES
En los pacientes sospecha de nódulos tiroideos o con nódulos tiroideos evidentes, es recomendable obtener los siguientes antecedentes personales y familiares:
- Antecedentes familiares de feocromocitoma, hiperparatiroidismo y cáncer de tiroides en familiares de primer grado.
- Antecedentes personales de otras enfermedades malignas.
- Tratamiento con radioterapia (cabeza y cuello) en la infancia.
- Radiación corporal total para el trasplante de médula ósea.
- Exposición a las radiaciones ionizantes.
- Síntomas compresivos en el cuello como dificultad para tragar o respirar y cambios en el tono de la voz.
Contenido educativo complementario
Puede que no todo sea sobrediagnóstico: El posible papel de las exposiciones ambientales en el aumento de la incidencia del cáncer de tiroides
Presentadora: Dra. Maaike van Gerwen
Resumen
- 4:53 - Factores que afectan a la incidencia
El Dr. van Gerwen analiza los factores que pueden aumentar la incidencia del cáncer de tiroides, como el sobrediagnóstico, la obesidad y la exposición a metales pesados. - 21:37 - Sustancias químicas alteradoras endocrinas (SAE)
El Dr. Van Gerwen explica cómo la exposición a determinadas sustancias químicas altera la función endocrina y aumenta el riesgo de cáncer de tiroides, utilizando como ejemplo las secuelas del desastre del World Trade Center. - 37:02 - Proteómica, metabolómica y EDC
La Dra. van Gerwen destaca otro estudio realizado por ella en el que su equipo utilizó la metablómica y la proteómica para estudiar las vías que relacionan las SAE con el cáncer de tiroides.
Inequidad de género en el diagnóstico del cáncer de tiroides
Presentador: Karissa LeClair, MD
Resumen
La Dra. Karissa LeClair discute el tema de la desigualdad de género en el diagnóstico del cáncer de tiroides. La Dra. Louise Davies, la Dra. Margaret Brandwein-Weber, el Dr. Camilo González-Velázquez y el Dr. Mack Harrell se unen a nosotros como panelistas para dirigir el debate de esta sesión.
- La incidencia del cáncer de tiroides ha aumentado con el tiempo, pero sin un cambio correspondiente en la mortalidad. (4:59)
- Un estudio de 2014 demostró que el aumento absoluto del cáncer de tiroides en las mujeres era casi 4 veces mayor que el de los hombres. (8:23)
- No hubo diferencias en el reservorio de CTP latente entre hombres y mujeres. En otras palabras, la prevalencia subyacente del cáncer de tiroides era igual en hombres y mujeres, lo que contrastaba directamente con las tendencias de incidencia y mortalidad. (12:30)
- La proporción de diagnósticos entre hombres y mujeres estratificada en función de la letalidad del subtipo de cáncer de tiroides. (15:38)
- Las mujeres son desproporcionadamente diagnosticadas con cánceres papilares pequeños y localizados (4,28:1). (17:09)
- Las mujeres tienen más probabilidades de que se les diagnostique un cáncer de tiroides subclínico. Los hombres corren el riesgo de ser diagnosticados más tarde. (18:07)
- Las mujeres utilizan la asistencia sanitaria con más frecuencia que los hombres. Esto genera más oportunidades de vigilancia y diagnóstico. (18:37)
- Es más probable que las mujeres sean derivadas para la realización de una ecografía tiroidea y que se sometan a una ecografía tiroidea como imagen inicial. Estas variaciones en la práctica pueden contribuir a una mayor detección de cánceres papilares pequeños y localizados en las mujeres. (19:19)
- Las tasas dispares de cáncer de tiroides en las mujeres han sido impulsadas principalmente por la detección de cánceres papilares pequeños y localizados sin un beneficio de mortalidad significativo. (21:30)
- La disparidad de género que se observa en el diagnóstico del cáncer de tiroides puede deberse principalmente a las variaciones en la utilización de la asistencia sanitaria y a nuestros propios patrones de práctica. (22:02)
- Comienza el debate sobre las posibles disparidades geográficas en la incidencia del cáncer de tiroides. (31:58)
- Comienza la discusión sobre la prevalencia de la tiroiditis de Hashimoto entre las mujeres. (39:11)
- Comienza la discusión sobre el uso de la frase "inequidad de género". (51:02)
Tablas y figuras
Tabla 4. Formas familiares y hereditarias del cáncer de tiroides
Poliposis adenomatosa familiar
| Gene | APC |
| Enfermedad tiroidea benigna | 40% |
| Cáncer | 0,4-12% |
| Tipos de cáncer | CMV-PTC: 63% FV-PTC: 25% PTC: 12% |
Tumor PTEN-Hamartoma (Cowden)
| Gene | PTEN |
| Enfermedad tiroidea benigna | 75% |
| Cáncer | 35% |
| Tipos de cáncer | PTC: 50% FV-PTC: 28% FTC: 14% |
Complejo Carney Tipo 1
| Gene | PRKARIA |
| Enfermedad tiroidea benigna | ≤ 75% |
| Cáncer | < 5% |
| Tipos de cáncer | PTC FTC |
Asociado a RET
| Gene | RET |
| Enfermedad tiroidea benigna | - |
| Cáncer | 100% |
| Tipos de cáncer | MTC |
DICER1
| Gene | DICER1 |
| Enfermedad tiroidea benigna | ≤ 30% |
| Cáncer | - |
| Tipos de cáncer | FTC FV-PTC |
CMV = Variante Morular Cribiforme; FV = Variante Folicular
Los porcentajes se refieren a la prevalencia de la enfermedad.
B. Examen físico1-3
ATA // AACE // JAES
En los pacientes con factores de riesgo de cáncer de tiroides o con síntomas relacionados con los nódulos tiroideos, debe realizarse una exploración física centrada en la glándula tiroidea y los ganglios linfáticos cervicales.
2. Pruebas de laboratorio
A. Evaluación de Tirotropina (TSH), Tiroglobulina (Tg) y Calcitonina
ATA // ESMO // JAES
Medición de la TSH se recomienda para evaluar los nódulos tiroideos recién diagnosticados. Los nódulos hiperfuncionales tienen más probabilidades de ser benignos que los no hiperfuncionales.1,2
Tiroglobulina sérica Antes de la tiroidectomía total, la medición de tiroglobulina no es una prueba precisa para evaluar la malignidad de la tiroides. Por lo tanto, en pacientes con nódulos tiroideos, no se recomienda la medición de tiroglobulina sérica previo al tratamiento quirúrgico.1,2
Calcitonina sérica puede ayudar a identificar a los pacientes con nódulos tiroideos que albergan cánceres medulares de tiroides.4
- Sin embargo, debido a que el cáncer medular de tiroides es poco frecuente, y los niveles de calcitonina podrían ser falsamente elevados, las recomendaciones de distintas sociedades son discordantes con respecto a la medición rutinaria de la calcitonina sérica en pacientes con nódulos tiroideos.1,4
3. Estudios de imagen
A. Ultrasonido (US) en la evaluación de los nódulos tiroideos
ATA // NCCN // TIRADS
Se recomienda realizar una ecografía tiroidea con evaluación de los ganglios linfáticos cervicales en todos los pacientes en los que se sospeche la existencia de un nódulo tiroideo, o en los que se haya identificado previamente un nódulo a través de la exploración física o incidentalmente en otras modalidades de estudios de imagen.
Se recomienda evaluar y registrar las características ecográficas como la composición, ecogenicidad, forma, características de los márgenes del nódulo y presencia de focos ecogénicos.1,5,6
Se recomienda evaluar la totalidad de un nódulo para describir sus características, como el tamaño, la ubicación, la composición, la ecogenicidad, los márgenes, la forma y la presencia o ausencia de calcificaciones. Estas características ayudan a clasificar el riesgo de malignidad y a guiar la toma de decisiones sobre realización de biopsias por aspiración con aguja fina (BAAF).
Existe un consenso en las recomendaciones de distintas sociedades sobre las características ecográficas que deben evaluarse. Sin embargo, existe una leve discordancia en el uso de los diferentes sistemas de clasificación utilizados para ayudar a la toma de decisiones de realización de BAAF. Los dos sistemas de clasificación más utilizados se basan en:1,5,6
- Reconocimiento de patrones de ultrasonido (ATA).
- Sistemas de puntuación basados en características ecográficas (TI-RADS de Colegio Americano de Radiología).
i. Enfoque basado en patrones sonográficos
ii. Sistemas de puntuación basados en las características ecográficas individuales
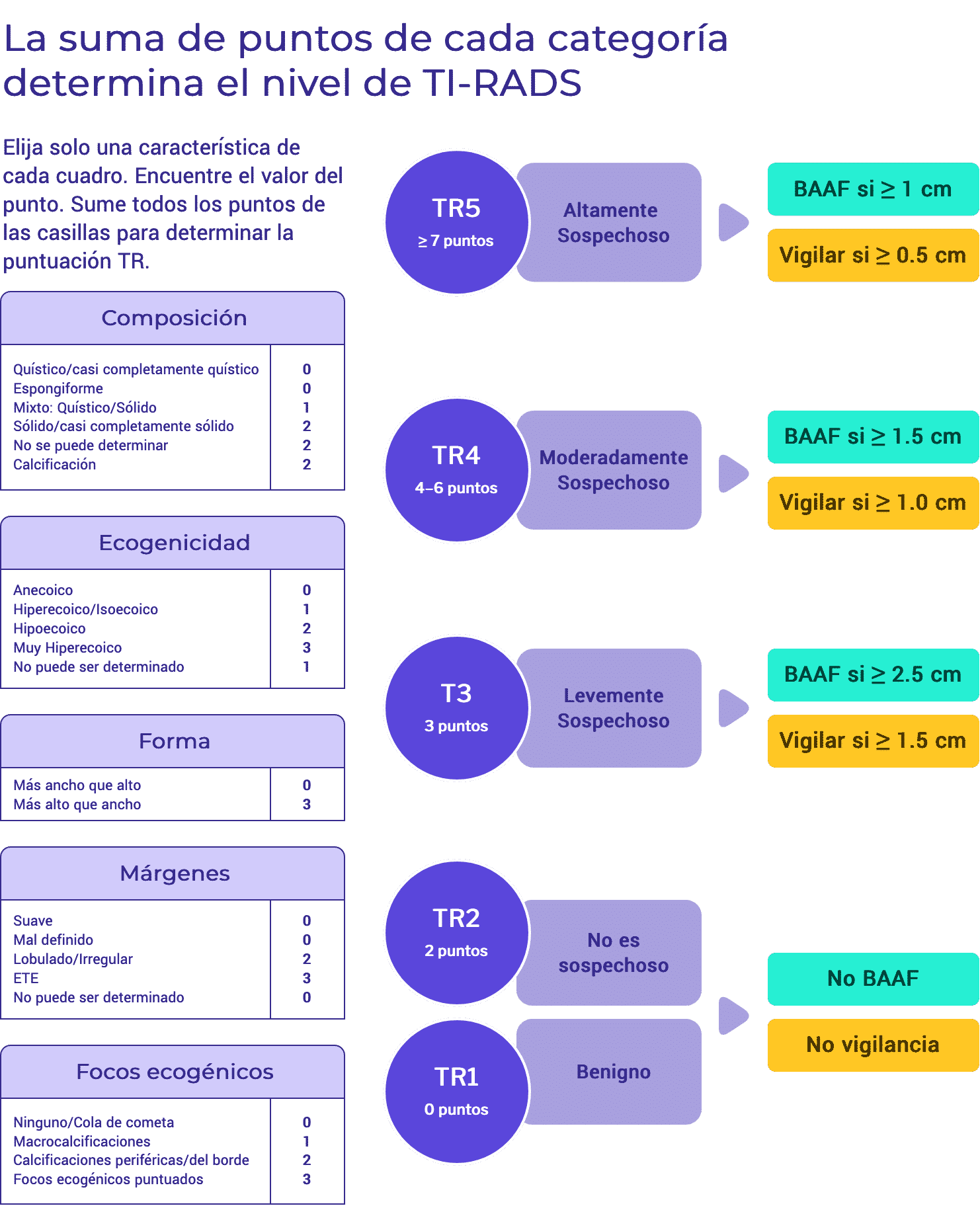
Las recomendaciones para la biopsia por aspiración con aguja fina se basan en las características ecográficas de un nódulo (nivel TIRADS) y en el diámetro máximo del nódulo. En los niveles TR3 a TR5, este sistema sugiere cortes de tamaño para los que se recomienda la BAAF, así como límites de tamaño inferiores para los que se recomiendan exámenes ecográficos de seguimiento.6
B. Uso del Ultrasonido para la toma de decisiones sobre toma de biopsia (BAAF)1,5,6
ATA // NCCN // TIRADS
- La biopsia por aspiración con aguja fina (BAAF), guiada por ultrasonido, es el estándar de oro para la evaluación diagnóstica de los nódulos tiroideos clínicamente relevantes. La relevancia clínica se determina mediante la medición del tamaño del nódulo y el análisis de las siguientes características ecográficas: forma, ecogenicidad, descripción de los bordes, y presencia de puntos ecogénicos.
- La BAAF no se recomienda cuando el diámetro del nódulo es < 1 cm, independientemente de las características ecográficas.
Clasificación de riesgo de malignidad en nódulos tiroideos utilizando puntuaje basado en sus características (TI-RADS ACR)
- La biopsia por aspiración con aguja fina (BAAF), guiada por ultrasonido, es el estándar de oro para la evaluación diagnóstica de los nódulos tiroideos clínicamente relevantes. La relevancia clínica se determina mediante la medición del tamaño del nódulo y el análisis de las siguientes características ecográficas: forma, ecogenicidad, descripción de los bordes, y presencia de puntos ecogénicos.
- La BAAF no se recomienda cuando el diámetro del nódulo es < 1 cm, independientemente de las características ecográficas.
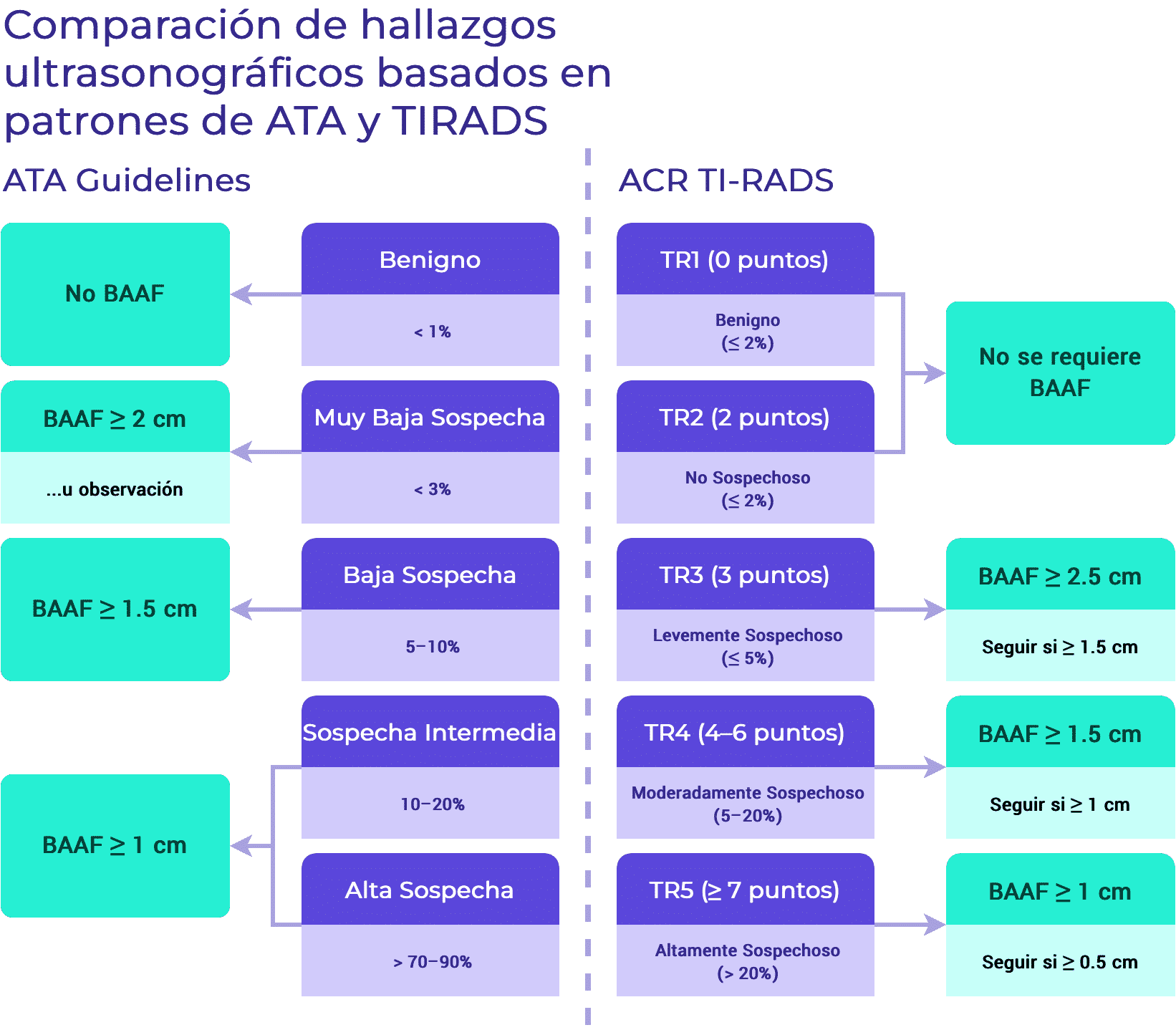
- Se recomienda realizar UG-FNA en nódulos altamente sospechosos > 1 cm de diámetro. Los nódulos altamente sospechosos se definen como nódulos con una suma de ≥ 7 puntos basada en la presencia de características ecográficas.
- Los nódulos altamente sospechosos pueden ser observados con US si son menores de 1 cm.5,6
- Se recomienda realizar una UG-FNA en nódulos moderadamente sospechosos de más de 1,5 cm de diámetro. Los nódulos moderadamente sospechosos se definen como nódulos con una suma en el rango de 4-6 puntos basada en la presencia de características ecográficas.
- Los nódulos moderadamente sospechosos pueden observarse con US si son menores de 1,5 cm. 5,6
- Se recomienda realizar una UG-FNA en nódulos tiroideos ligeramente sospechosos de más de 2,5 cm de diámetro. Los nódulos ligeramente sospechosos se definen como nódulos con una suma de 3 puntos basada en la presencia de características ecográficas.
- Los nódulos ligeramente sospechosos pueden ser observados con US si son menores de 2,5 cm. 5,6
- La UG-FNA no se recomienda para los nódulos que se consideran no sospechosos según su aspecto ecográfico. Los nódulos tiroideos se clasifican como no sospechosos si su aspecto ecográfico da lugar a una suma de 2 puntos.
- Los nódulos tiroideos clasificados como no sospechosos no requieren seguimiento con US.
- La UG-FNA no se recomienda para los nódulos que se consideran benignos por su aspecto ecográfico. Los nódulos tiroideos se clasifican como benignos si su aspecto ecográfico da lugar a la suma de 0 puntos.
- Los nódulos tiroideos de apariencia benigna no requieren seguimiento con US.5,6
Clasificación de riesgo de malignidad utilizando patrones de sospecha (ATA)1
- Se recomienda realizar una UG-FNA en nódulos tiroideos de más de 1 cm de diámetro con un patrón ecográfico de alta sospecha. Los nódulos de alta sospecha se definen como nódulos hipoecoicos con una o más de las siguientes características:
- Márgenes irregulares, microcalcificaciones, forma más alta que ancha, calcificaciones en el borde con pequeño componente de tejido blando extrusivo o evidencia de ETE.
- Se recomienda realizar UG-FNA en nódulos tiroideos > 1 cm de diámetro con patrón ecográfico de sospecha intermedia. Los nódulos de sospecha intermedia se definen como nódulos hipoecoicos sin microcalcificaciones, ETE o forma más alta que ancha.
- Se recomienda realizar UG-FNA en nódulos tiroideos > 1,5 cm de diámetro con patrón ecográfico de baja sospecha. Los nódulos de baja sospecha se definen como nódulos hiperecoicos o isoecoicos, o nódulos parcialmente quísticos con áreas sólidas excéntricas sin microcalcificaciones, márgenes irregulares o ETE o forma más alta que ancha.
- La UG-FNA puede ser considerada en nódulos tiroideos > 2 cm en su mayor dimensión con patrón ecográfico de muy baja sospecha. Los nódulos de muy baja sospecha se definen como nódulos espongiformes o parcialmente quísticos sin ninguna de las características ecográficas descritas en los patrones de sospecha baja, intermedia o alta.
- Los nódulos puramente quísticos y otros nódulos que no cumplen los criterios descritos anteriormente no se sugieren para someterse a una biopsia por US-FNA.
Contenido educativo complementario
Investigación del efecto de la localización de los nódulos tiroideos en el riesgo de cáncer de tiroides
Presentador: Sina Jasim, MD, MPH & Franklin N. Tessler, MD
Resumen
La Dra. Sina Jasim y el Dr. Franklin Neil Tessler discuten los hallazgos de un estudio relacionado con el impacto de la ubicación de los nódulos tiroideos en el riesgo de cáncer de tiroides y comentan las implicaciones que estos hallazgos tienen para los sistemas de estratificación del riesgo radiológico.
- El Dr. Sina Jasim ofrece una visión general de ambos características intrínsecas y no intrínsecas que determinan el muestreo del nódulo. Las características intrínsecas incluyen las características ecográficas y la ecografía con contraste, mientras que las características no intrínsecas consisten en la afectación de los ganglios linfáticos, la invasión extratiroidea y quizás la localización de un nódulo.
- En un resumen de su estudio Al investigar el efecto de la ubicación del nódulo tiroideo en el riesgo de cáncer de tiroides, el Dr. Sina Jasim concluye que la ubicación es un factor de riesgo independiente para el riesgo de malignidad y que dicho riesgo de malignidad es mayor en la región del istmo.
- El Dr. Sina Jasim describe la rendimiento de los algoritmos de riesgo revisados que reflejan el riesgo añadido de los nódulos tiroideos en determinadas regiones geográficas. Destaca un descenso en el rendimiento de todos los algoritmos revisados, excepto una adición de 1 punto a los nódulos del istmo.
- El Dr. Franklin Tessler hace hincapié en los problemas relacionados con el gran número de sistemas y directrices de riesgo de la imagen tiroidea, lo que le llevó a formar el Grupo de Trabajo Internacional de Ecografía Tiroidea.
Macrocalcificaciones y riesgo de malignidad en el sistema de patrones sonográficos ATA
Presentador: Kristen Kobaly, MD
Resumen
El Sistema de Patrones Sonográficos de la Asociación Americana de Tiroides (ATASPS) describe 5 niveles de sospecha de malignidad basados en la apariencia sonográfica de un nódulo tiroideo. Sin embargo, 3-37% de los nódulos no son clasificables cuando la combinación de hallazgos en escala de grises no es representada por el ATASPS.
Las únicas calcificaciones incluidas en el ATASPS son las de los nódulos sólidos hipoecoicos de alta sospecha (HS) e incluyen tanto las microcalcificaciones como las calcificaciones interrumpidas periféricas con extrusión de tejidos blandos. Los nódulos no hipoecoicos con estos y otros patrones de calcificación, que definimos como calcificaciones de no alta sospecha (CNS), no son clasificables por el ATASPS. Se evaluó el efecto de asignar un nivel de riesgo ATASPS a los nódulos con calcificaciones no altamente sospechosas basándose en el análisis de sus otras características en escala de grises.
- 7:47 Calcificaciones de nódulos tiroideos en la literatura
La Dra. Kristen Kobaly discute las tendencias en la literatura en torno a las calcificaciones de los nódulos tiroideos, haciendo hincapié en la heterogeneidad de los estudios que analizan las macrocalcificaciones. - 25:42 Las macrocalcificaciones y el futuro
La Dra. Kobaly propone recomendaciones para evaluar el nivel de riesgo asociado a las macrocalcificaciones en los nódulos tiroideos, basándose en los resultados de su estudio. - 45:51 Por qué es importante el análisis de las macrocalcificaciones
El Dr. Javad Azadi describe la importancia de analizar el riesgo asociado a las macrocalcificaciones en los nódulos tiroideos, destacando las discrepancias significativas entre ACR-TIRADS y ATASPS con respecto a esta característica.
Acuerdo de los clínicos en la clasificación de las características ecográficas de los nódulos tiroideos: Un estudio de dos sociedades de endocrinología
Presentador: Nydia Burgos, MD
Resumen
- 9:20 Revisión de los resultados
El Dr. Burgos presenta una serie de gráficos en los que se muestra el nivel de acuerdo entre evaluadores en comparación con el valor de referencia AC1 de 0,6 que define el límite entre un acuerdo moderado y uno sustancial. - 16:31 Presentación del Dr. Tessler
- 19:34 ACR TI-RADS
El Dr. Tessler presenta las 5 categorías de características de ACR TI-RADS y los 18 descriptores
4. Manejo de los nódulos tiroideos benignos1
ATA
Se puede considerar la cirugía para los nódulos tiroideos benignos cuando tienen más de 4 cm de diámetro, especialmente si se detecta un patrón de crecimiento o si hay síntomas de compresión.
5. Pruebas moleculares1
ATA // NCCN
- Las pruebas moleculares pueden ayudar a guiar el manejo clínico en pacientes que tienen un resultado indeterminado en una BAAF de tiroides (Bethesda III o IV) sin un alto nivel de preocupación clínica o radiológica de malignidad.5
- También se puede considerar la realización de pruebas moleculares en pacientes con un resultado de la BAAF de tiroides sospechoso de malignidad (Bethesda V) si los resultados de dichas pruebas pueden influir en el tratamiento quirúrgico.
- Estas pruebas moleculares deben realizarse en laboratorios debidamente certificados (CLIA o CAP en los Estados Unidos).
- Se debe asesorar a los pacientes sobre los beneficios y las limitaciones de las pruebas moleculares, así como sobre la incertidumbre en cuanto a la importancia de los resultados de las pruebas moleculares.
- Aunque las recomendaciones de la ATA no lo indiquen explícitamente, hay coincidencia en que si los resultados de las pruebas moleculares (junto con los hallazgos clínicos y radiológicos) sugieren una lesión benigna, se recomienda la vigilancia de los nódulos según las directrices para un resultado de BAAF benigno.5
- Si las pruebas moleculares sugieren malignidad, se recomienda la escisión diagnóstica (lobectomía o tiroidectomía total).5
- Si las pruebas moleculares indican una alta probabilidad de carcinoma papilar (particularmente un BRAFV600E mutación, translocación RET/PTC), el tratamiento debe ser el indicado para un diagnóstico de carcinoma papilar por AAF.
Relacionado: Tratamiento inicial del cáncer de tiroides
- No se ha aprobado ninguna prueba molecular específica como preferida.
Contenido educativo complementario
Valor predictivo de un clasificador genómico en nódulos tiroideos indeterminados basado en el tamaño del nódulo
Presentador: Babak Givi, MD
Importancia: Los clasificadores genómicos se desarrollaron para guiar mejor a los clínicos en el tratamiento de los nódulos tiroideos indeterminados (NTI). Hasta donde sabemos, no se ha estudiado previamente si existe una variación en la precisión diagnóstica de estas pruebas en función del tamaño del NTI.
Objetivo: Analizar el rendimiento diagnóstico de un clasificador genómico en relación con el tamaño del ITN.
- 22:23 Perfiles genómicos de los nódulos malignos
El Dr. Givi presenta un perfil genómico de los nódulos cancerosos y sus mutaciones genéticas. - 28:19 Masa tiroidea poco diferenciada
El Dr. Givi presenta un caso en el que Thyroseq no identificó alteraciones genéticas específicas del tiroides. - 40:20 NIFTP
El Dr. Nikiforov habla de la NIFTP (neoplasia folicular tiroidea no invasiva con características nucleares de tipo papilar) que debe ser resecada quirúrgicamente.
Rendimiento de un clasificador genómico multigénico en nódulos tiroideos con citología indeterminada
Presentador: Yuri Nikiforov, MD, PhD
El Dr. Yuri Nikiforov presenta un estudio internacional prospectivo doble ciego realizado para determinar la validación clínica de ThyroSeq v3 GC. El Dr. Zubair Baloch se une como ponente invitado y presenta el estado actual de la citología tiroidea.
- La biopsia por aspiración con aguja fina determina eficazmente el diagnóstico de los nódulos tiroideos. Sin embargo, el 20-30% de los nódulos se clasifica como indeterminado. Las pruebas moleculares se utilizan para identificar si estos nódulos son benignos o malignos, y si son de bajo o alto riesgo, lo cual es una información importante para decidir el tratamiento del paciente.
- El Dr. Yuri conceptualiza la sensibilidad y especificidad del Clasificador Genómico Multigen en una muestra de 100 pacientes con citología Bethesda III-IV (17:20).
- El Dr. Yuri llama la atención sobre la cuestión fundamental de utilizar un sistema de clasificación binario para los nódulos (benignos o malignos), cuando en realidad existe un continuo de características nucleares. Este reto llevó a la introducción del concepto "NIFTP" (Non-Invasive Follicular Thyroid Neoplasm with Papillary-like Nuclear Features).
- El Dr. Baloch destaca la inclusión de categorías indeterminadas en la primera edición del Esquema de Clasificación de Bethesda para la citología de nódulos tiroideos. La aplicación de este esquema de clasificación puso de manifiesto la variación en el riesgo de malignidad, especialmente para las categorías indeterminadas. Este hallazgo condujo a la creación de la segunda edición de este sistema.
Mutaciones genéticas en el cáncer de tiroides
Presentador: Jeffrey Krane, MD, PhD
El Dr. Jeffrey Krane imparte una conferencia sobre las mutaciones genéticas en el manejo del cáncer de tiroides y su papel en el diagnóstico y el tratamiento.
- El proyecto Atlas Genético del Cáncer (TCGA) reveló una variedad de mutaciones conductoras del carcinoma papilar de tiroides (CPT) no descubiertas previamente.
- El TCGA nos permitió separar los carcinomas papilares en 2 grandes grupos de tumores: BRAF-like (variantes de células altas y clásicas) y RAS-like (FVPTC, se parecen a las neoplasias foliculares).
- El panorama molecular de las neoplasias tiroideas es complejo.
- La mera presencia de una mutación no equivale necesariamente a la presencia de malignidad, especialmente en la familia de mutaciones RAS.
- Hay ciertas mutaciones de alto riesgo cuya mera identificación puede presagiar la presencia de una neoplasia (por ejemplo, BRAF V600E, promotor de TERT).
- También hay mutaciones de riesgo intermedio (por ejemplo, RAS).
- En general, no es necesario conocer el perfil mutacional subyacente de un tumor tiroideo para emitir un diagnóstico, ya que la mayoría de los diagnósticos se basan en la morfología o el fenotipo.
- Sin embargo, las pruebas moleculares son importantes en el contexto de la citología, especialmente para los aspirados indeterminados de bajo riesgo (Bethesda III y IV).
- Las pruebas moleculares pueden utilizarse como una intervención para ayudar a determinar si un paciente requerirá cirugía, la extensión de la cirugía requerida o las terapias dirigidas apropiadas para la enfermedad avanzada.
- Las pruebas comerciales más populares son Thyroseq v3 (UPMC/PathCBL), Afirma GSC (Veracyte) y ThyGeNEXT/ThyroMIR (Interpace Diagnostics).
Diagnóstico molecular 101
Presentador: Jane Houldsworth, PhD
Los doctores Houldsworth y Mehrota ofrecen una visión de alto nivel sobre los fundamentos de los ensayos y tecnologías utilizados para detectar mutaciones genéticas somáticas, translocaciones y alteraciones del número de copias.
Resumen
En el Virtual Journal Club de esta semana, nos complace dar la bienvenida a la Dra. Jane Houldsworth y a la Dra. Meenakshi Mehrota. La Dra. Houldsworth es la Directora del Laboratorio Clínico Molecular y Vicepresidenta de la División de Patología Molecular de Mount Sinai. La Dra. Mehrota es Profesora Adjunta de Patología en Mount Sinai, y también es Directora Adjunta del Laboratorio de Patología Molecular. Juntos, ofrecieron una visión general de los ensayos y tecnologías utilizados para detectar mutaciones somáticas e identificar translocaciones genéticas y alteraciones del número de copias. Su investigación ha contribuido significativamente a la investigación de traslación en Mount Sinai en un esfuerzo por aplicar nuevas plataformas de diagnóstico a la oncología clínica.
El Dr. Houldsworth habló de los fundamentos de la carga tumoral, que se calcula como el número de núcleos tumorales ÷ (número de núcleos tumorales + número de núcleos benignos).
- La detección y la sensibilidad del análisis de la carga tumoral informan críticamente el método de disección del tumor.
- Cuanto mayor sea la carga tumoral, mayor será la probabilidad de detectar la mutación que impulsa la formación del cáncer
A la hora de analizar la información genética del paciente, existen diversos niveles de especificidad que van desde la exhaustividad hasta la secuenciación de un solo gen.
- Secuenciación del genoma completo (WGS): método que consiste en secuenciar todo lo que hay dentro del cromosoma de un núcleo. Esto incluye los exones que se convierten en la transcripción final de la información de las proteínas y los intrones que se eliminan antes de la codificación de las proteínas.
- Secuenciación del exoma completo (WES): métodos para secuenciar sólo los exones de los genes que codifican proteínas.
- Secuenciación de objetivos: Permite a los analistas seleccionar los puntos calientes regionales donde se encuentran frecuentemente las mutaciones.
- Ahora podemos ser tan específicos como los genes individuales y las variantes individuales dentro de esos genes. Cuanto más específico sea el análisis, menos exhaustivo será, pero con mayores posibilidades de detección.
A continuación, el Dr. Mehrota nos ilustró sobre los detalles básicos de la reacción en cadena de la polimerasa (PCR). La PCR es un método de replicación de una secuencia específica de ADN en cantidades masivas para permitir un análisis más detallado. La secuenciación de Sanger, por ejemplo, utiliza la PCR
Eficacia de las técnicas de pruebas moleculares para el diagnóstico de nódulos tiroideos indeterminados: Un ensayo clínico aleatorio
Presentador: Masha Livhits, MD
Resumen
La Dra. Masha Livhitz y el Dr. Bryan McIver discuten el papel de las pruebas de marcadores moleculares en referencia al diagnóstico de nódulos tiroideos indeterminados.
La Dra. Masha Livhits presenta el dilema del nódulo tiroideo indeterminado y el papel que pueden desempeñar las pruebas de marcadores moleculares para abordar este dilema.
La Dra. Masha Livhits comenta los resultados de un estudio en el que se compararon pruebas de marcadores moleculares (Afirma GEC y Thyroseq v2 en la fase 1, Afirma GSC y Thyroseq v3 en la fase 2).
- En la fase 1, Thyroseq v2 tuvo una mejor tasa de llamadas benignas y especificidad en comparación con Afirma GEC.
- En la fase 2, Thyroseq v3 y Afirma GSC tuvieron el mismo rendimiento.
El Dr. Bryan McIver destaca que las pruebas de marcadores moleculares están dejando de utilizarse como una construcción binaria en la que los pacientes con cualquier mutación reciben una tiroidectomía total y los que no tienen mutaciones son seguidos. Más bien, se evalúan tipos específicos de mutaciones en un espectro para determinar la agresividad del tratamiento necesario.
- Por ejemplo, los pacientes con mutaciones de bajo riesgo pueden recibir una lobectomía terapéutica en lugar de una tiroidectomía total.
Rendimiento de un clasificador genómico multigénico en nódulos tiroideos con citología sospechosa de malignidad
Presentador: Dr. John Skaugen
Resumen
- 6:46 - Evaluación de las pruebas moleculares para los nódulos tiroideos
El Dr. Skaugen habla sobre el objetivo de su estudio, que consiste en evaluar el rendimiento diagnóstico de las pruebas moleculares (MT) para nódulos tiroideos sospechosos de malignidad (SFM) en citología. - 7:14 - Aplicación de pruebas moleculares a muestras de FNA
El Dr. Skaugen ofrece una visión general de la metodología del estudio, explicando cómo se aplicó la MT y cómo se resolvieron las discrepancias entre la MT y los resultados histológicos. - 11:01 - Malignidades y mutaciones
El Dr. Skaugen analiza cómo las tasas de malignidad y mutación difieren en función de los resultados de la MT. - 17:55 - Conclusiones del estudio
El Dr. Skaugen resume las conclusiones del estudio, haciendo hincapié en cómo la MT puede predecir el resultado histológico y los grupos de riesgo molecular (MRG) se correlacionan con el riesgo de recurrencia del cáncer en los nódulos tiroideos con citología SFM.
6. Gestión basada en los hallazgos citológicos
ATA // NCCN // TIRADS
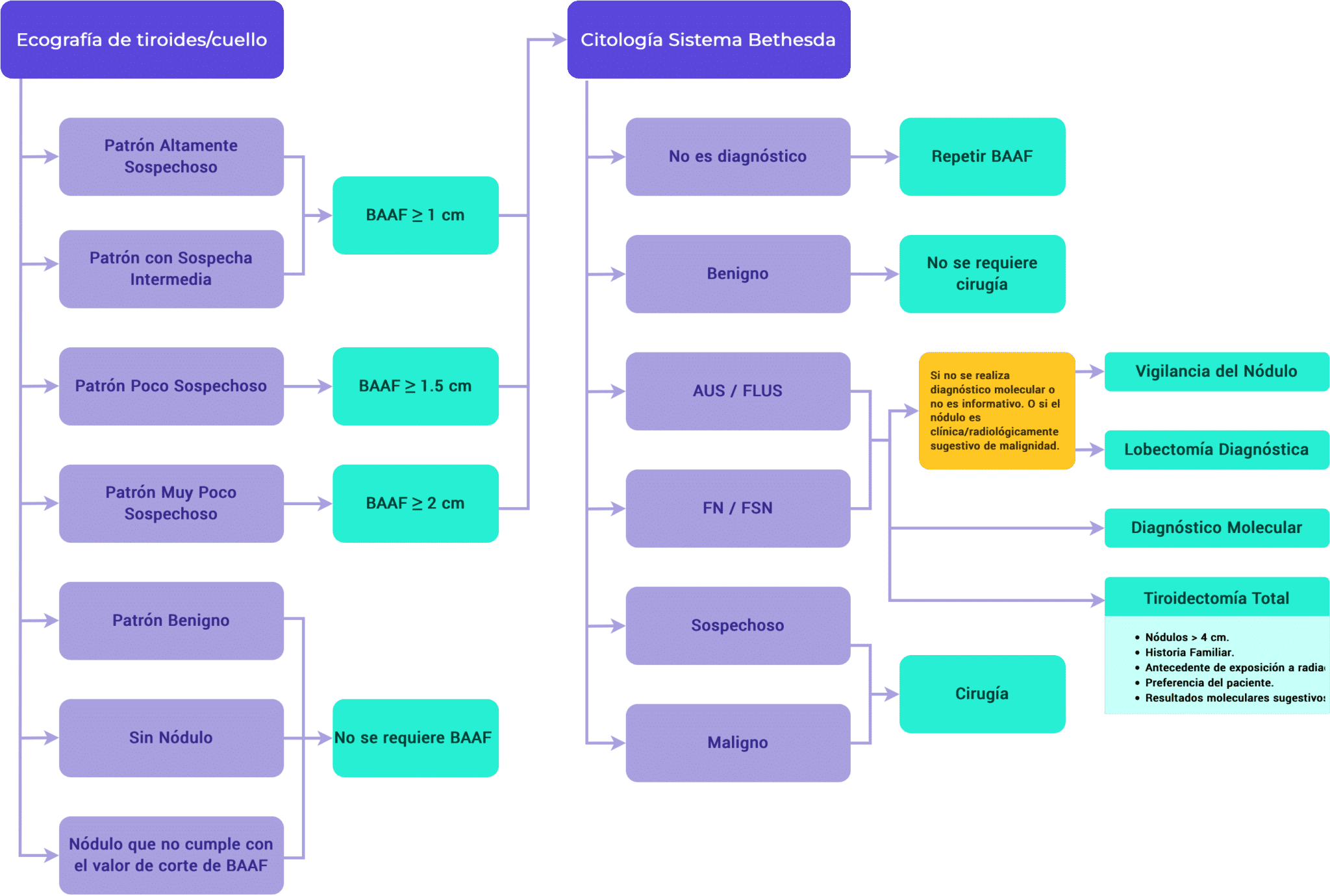
A. No diagnóstico (Bethesda I)
| Riesgo de malignidad |
| 5-10% |
| Incluida la histología |
| - No diagnóstico o insatisfactorio Sólo líquido de quiste, - Espécimen prácticamente acelular, - Otros (sangre oscura, artefacto de coagulación, artefacto de secado, etc.). |
- Un resultado inicial no diagnóstico de un nódulo sólido debe motivar la repetición de la PAAF con guía ecográfica y la evaluación citológica in situ si está disponible.1,5
- Si son quísticos, debe repetirse la PAAF si se identifica alguna zona preocupante desde el punto de vista ecográfico, los nódulos no diagnósticos repetidos que no son sospechosos desde el punto de vista ecográfico pueden tratarse con vigilancia continua o escisión diagnóstica.1,5
- La escisión quirúrgica debe considerarse si: 1,6
- El nódulo es ecográficamente muy sospechoso,
- Se identifica un crecimiento de > 20% en 2 dimensiones, o
- Existe una gran preocupación clínica por la malignidad.
B. Benigno (Bethesda II)
| Riesgo de malignidad |
| 0-3% |
| Incluida la histología |
| - Benigno, - Consistente con un nódulo folicular benigno (incluye nódulo adenomatoide, nódulo coloide, etc), - Consistente con tiroiditis linfocítica crónica (Hashimoto) en el contexto clínico adecuado, - Consistente con tiroiditis granulomatosa (subaguda), - Otros |
No es necesario un tratamiento inmediato para un FNA benigno.1
La vigilancia de los nódulos debe realizarse de acuerdo con la estratificación del riesgo por imágenes ecográficas, tal como se define:1,5,6
- Alta sospecha: repetir la ecografía y la biopsia por aspiración con aguja fina en un plazo de 12 meses.
- Sospecha baja-intermedia: repetir la ecografía a los 12-24 meses y considerar la repetición de la PAAF en caso de crecimiento de > 20% en 2 dimensiones (al menos 2 mm o aumento de volumen > 50%) o nuevos hallazgos de imagen preocupantes.
- Sospecha muy baja: no hay vigilancia ni imágenes después de 24 meses.
- Si se obtienen 2 resultados de FNA benignos en el mismo nódulo, no se necesita más vigilancia para ese nódulo.
C. AUS/FLUS (Bethesda III)1,5
| Riesgo de malignidad |
| 10-30% |
| Incluida la histología |
| - Atipia de importancia indeterminada - Lesión folicular de importancia indeterminada |
La lobectomía diagnóstica o la vigilancia de los nódulos (guiada por factores de riesgo clínicos y radiológicos y por la preferencia del paciente) puede considerarse tras un diagnóstico inicial o repetido de AUS/FLUS, o si las pruebas moleculares no se realizan o no son informativas.
La lobectomía diagnóstica o la tiroidectomía total están indicadas si las pruebas moleculares arrojan un resultado sospechoso.
La tiroidectomía total puede ser apropiada para la escisión diagnóstica en función de las imágenes y las preocupaciones clínicas, como por ejemplo
- Tamaño del nódulo grande (> 4 cm),
- Historia familiar,
- Historial de exposición a la radiación,
- La preferencia del paciente, o
- Resultados de las pruebas moleculares.
Si los resultados de las pruebas moleculares (junto con los hallazgos clínicos y radiológicos) sugieren una lesión benigna, se recomienda la vigilancia del nódulo según las directrices para un resultado de FNA benigno.
D. Sospecha de neoplasia folicular (o de células de Hürthle) (Bethesda IV)1,5
| Riesgo de malignidad |
| 25-40% |
| Incluida la histología |
| - Neoplasia folicular, o - Sospecha de una neoplasia folicular, incluyendo el tipo oncocítico (células de Hürthle) |
Si la clínica o la radiografía son preocupantes para la malignidad, se debe realizar una lobectomía diagnóstica o una tiroidectomía total.
De lo contrario, se puede considerar la realización de pruebas moleculares para informar la toma de decisiones.
La escisión diagnóstica está indicada si las pruebas moleculares no se realizan, no son informativas o arrojan un resultado sospechoso.
La vigilancia de los nódulos puede considerarse si el nódulo es de bajo riesgo o si el paciente prefiere la vigilancia.
La tiroidectomía total puede ser apropiada para la escisión diagnóstica en función de las imágenes y las preocupaciones clínicas, como por ejemplo
- Tamaño del nódulo grande (> 4 cm),
- historia familiar,
- historial de exposición a la radiación,
- la preferencia del paciente, o
- resultados de las pruebas moleculares.
Si los resultados de las pruebas moleculares (junto con los hallazgos clínicos y radiológicos) sugieren una lesión benigna, se recomienda la vigilancia del nódulo según las directrices para un resultado de FNA benigno.
Contenido educativo complementario
La presencia de células de Hürthle no aumenta el riesgo de malignidad en la mayoría de las categorías de Bethesda en los aspirados con aguja fina de tiroides
Presentador: Carrie Lubitz, MD, MPH
La Dra. Carrie Lubitz presenta un estudio retrospectivo para analizar cómo la presencia de células de Hürthle afecta al riesgo de malignidad. El Dr. Jeffrey Krane se une como comentarista invitado y se centra en la perspectiva del citopatólogo sobre las células de Hürthle.
- La cuarta edición de la clasificación de la OMS dedicó una categoría distinta al carcinoma de células de Hürthle debido a su perfil genético único
- Este estudio concluyó que el riesgo de malignidad, basado en el Sistema Bethesda de 2017 para informar sobre la citopatología tiroidea, no aumenta por la presencia de células de Hürthle
- El Dr. Krane detalla las condiciones no neoplásicas y neoplásicas en las que se ven las células de Hürthle (20:34)
- El Dr. Jeffrey Krane destaca que los patólogos tienen diferentes criterios para diagnosticar las células de Hürthle, así como para saber cuándo es necesario incluir estos hallazgos en sus informes (34:36)
- El Dr. Lubitz y el Dr. Krane comentan cómo influyen en la interpretación el tamaño de una lesión de células de Hürthle y la presencia de mutaciones TERT o RAS (48:21)
E. Sospecha de malignidad (Bethesda V)
| Riesgo de malignidad |
| 50-75% |
| Incluida la histología |
| - Sospecha de malignidad, - Sospecha de carcinoma papilar de tiroides, - Sospecha de carcinoma medular de tiroides, - Sospecha de carcinoma metastásico, - Sospechoso de linfoma, - Otros |
- El diagnóstico de FNA sospechoso de malignidad debe ser manejado de manera similar a un diagnóstico citológico maligno.1,5
- Se puede considerar la realización de pruebas moleculares de mutaciones en pacientes con un resultado de AAF de tiroides sospechoso de malignidad (Bethesda V) si los resultados de dichas pruebas pueden influir en el tratamiento quirúrgico.1
F. Maligno (Bethesda VI)1
| Riesgo de malignidad |
| 97-99% |
| Incluida la histología |
| - Maligno, - Carcinoma papilar de tiroides, - Carcinoma poco diferenciado, - Carcinoma medular de tiroides, - Carcinoma indiferenciado (anaplásico), - Carcinoma de células escamosas, - Carcinoma con características mixtas (especificar), - Malignidad metastásica, - Linfoma no Hodgkin, - Otros |
- La cirugía está generalmente indicada para un diagnóstico de carcinoma papilar en nódulos ≥ 1 cm.5
- La lobectomía puede ser apropiada para los carcinomas papilares de bajo riesgo de entre 1-4 cm con:5
- No hay evidencia de metástasis a distancia o en los ganglios.
- No hay evidencia de extensión extratiroidea.
- No hay exposición previa a la radiación.
- De lo contrario, se prefiere la tiroidectomía total.5
- La cirugía puede no estar indicada si:
- El paciente tiene una corta esperanza de vida.
- El paciente tiene comorbilidades significativas que aumentan el riesgo quirúrgico.
- El paciente tiene otros problemas de salud urgentes.
- La cirugía está generalmente indicada para un diagnóstico de carcinoma medular independientemente del tamaño.
- El carcinoma anaplásico necesita una evaluación adicional para valorar la resecabilidad del tumor.5
7. Evaluación de los nódulos tiroideos durante el embarazo1
ATA
- La PAAF de nódulos tiroideos clínicamente relevantes debe realizarse en mujeres embarazadas eutiroideas e hipotiroideas.7
- En el caso de las mujeres con niveles séricos de TSH suprimidos que persisten más allá de las 16 semanas de gestación, la FNA puede aplazarse hasta después del embarazo y el cese de la lactancia. En ese momento, se puede realizar una gammagrafía con radionúclidos para evaluar la función del nódulo si la TSH sérica sigue suprimida.
- El CTP descubierto por citología en el inicio del embarazo debe ser controlado ecográficamente. Si crece sustancialmente antes de las 24-26 semanas de gestación, o si la ecografía revela ganglios linfáticos cervicales sospechosos de enfermedad metastásica, debe considerarse la cirugía durante el embarazo. Sin embargo, si la enfermedad permanece estable a mediados de la gestación, o si se diagnostica en la segunda mitad del embarazo, la cirugía puede aplazarse hasta después del parto.
Contenido educativo complementario
Evaluación y gestión de los nódulos tiroideos durante el embarazo
Presentador: Spyridoula Maraka, MD
Revisión de la Epidemiología
Aunque la incidencia del cáncer de tiroides está aumentando en todo el mundo, el cáncer de tiroides durante el embarazo ha recibido menos atención en la literatura
Revisión de la biología
- La TSH baja puede estar relacionada con el embarazo y no ser motivo de preocupación
- El aumento del volumen tiroideo puede estar relacionado con cambios en la calcitonina y los factores de crecimiento, además de la deficiencia de yodo
- Durante el embarazo, las necesidades diarias de yodo aumentan en 50%
- Se recomiendan 150 mcg de yodo al día en forma de yodo potásico
Debate sobre la evaluación
- Historia clínica, palpación del cuello, análisis de sangre (pruebas de función tiroidea) ecografía del cuello, FNA
- La gammagrafía tiroidea y la captación no son posibles en las mujeres embarazadas
- Las directrices de la ATA desaconsejan el tratamiento supresor con LT4 debido al efecto secundario de la tirotoxicosis
- Para una mujer con nódulos benignos pero con síntomas de compresión, la escleroterapia puede ser una opción
- En el caso de una mujer con nódulos indeterminados, las pruebas moleculares no han sido validadas en el embarazo, y la gestación puede afectar a la expresión genética
- El primer y tercer trimestre no son seguros para la cirugía
- Los estudios han demostrado que los resultados son iguales para las mujeres embarazadas que se someten a la cirugía antes o después del parto, en su mayoría cáncer de tiroides de bajo riesgo
Revisión de la evidencia para el manejo de mujeres embarazadas
¿Cuál es la prevalencia de los nódulos tiroideos en el embarazo?
En dos estudios (Glinoer 1991 y Kung 2002), el embarazo no fue un factor de riesgo para el crecimiento de los nódulos tiroideos o la transformación maligna
- El volumen total del tiroides se mantuvo estable (Glinoer 1991)
- Aumento del volumen, pero vuelta a la línea de base (Kung 2002)
En un estudio, los investigadores descubrieron que los nódulos no aumentan de tamaño durante el embarazo
- El tamaño de la glándula tiroidea volvió a la normalidad, el tamaño de la glándula está relacionado con el aumento de peso (Vannucchi 2017)
¿Aumenta la frecuencia del cáncer de tiroides en mujeres embarazadas con nódulos tiroideos?
Sigue siendo una cuestión pendiente.
- Tres estudios retrospectivos sobre la frecuencia del cáncer de tiroides: 12% (n=57), 15% (n=40), 43% (n=16), pero pueden ser representaciones excesivas debido al sesgo de selección
- Kung 2002: 0% (n=34)
- Smith 2003: La prevalencia fue de 14,4/100.000 nacidos vivos en el primer año de posparto
Cáncer de tiroides durante el embarazo
Presentador: Fabián Pitoia, MD
El Dr. Fabián Pitoia habla de su enfoque para discutir con un nuevo paciente en el caso de un diagnóstico de cáncer de tiroides durante el embarazo.
Resumen
- El Dr. Fabián Pitoia describe la importancia de calmar a la paciente y a su familia en el caso de un diagnóstico de cáncer de tiroides durante el embarazo.
- El Dr. Fabián Pitoia afirma que probablemente no hay un peor resultado para el cáncer de tiroides durante el embarazo en comparación con el cáncer de tiroides fuera de este tiempo.
Consideraciones sobre el diagnóstico y el tratamiento del cáncer de tiroides en mujeres en edad reproductiva y en el período perinatal
Presentador: Dr. Evert van Velsen
Resumen
- 10:50 - Embarazo y fisiología tiroidea
El Dr. van Velsen analiza los cambios en el tamaño del tiroides y los niveles séricos de tiroglobulina durante el embarazo, que se normalizan tras el parto, así como la frecuencia de los nódulos tiroideos detectados en las pruebas de imagen durante el embarazo. Presenta directrices para el tratamiento del cáncer diferenciado de tiroides en función del trimestre del embarazo. - 15:17 - Más directrices sobre el embarazo
El Dr. van Velsen comenta las directrices de la ATA sobre la terapia con yodo radiactivo durante el embarazo o la lactancia. Además, presenta pruebas contradictorias sobre la frecuencia de resultados adversos del embarazo tras el tratamiento con yodo radiactivo. - 21:44 - Recomendaciones para la levotiroxina
El Dr. van Velsen presenta pruebas de Alexander et al. (2004) y Korevaar et al. (2017) que sugieren que la dosis de levotiroxina debe aumentarse en 25-30% durante el embarazo, aunque advierte de los riesgos del sobretratamiento. Una TSH sérica más baja y una tiroxina libre (FT4) más alta durante el embarazo se han asociado con un desarrollo fetal impedido. - 33:47 - El Dr. Davies presenta
El Dr. Davies discute la naturaleza contraintuitiva de cómo el cáncer de tiroides no parece ser más peligroso durante el embarazo que de otra manera, a pesar de la literatura científica básica que sugiere lo contrario. Él discute varios factores de crecimiento, específicamente IGF-1, que estimula el crecimiento de células tiroideas mediante la sinergia con TSH. Esto sugiere que el embarazo debería ser un momento peligroso para el cáncer de tiroides, ¡sin embargo no lo es! - 40:52 - Conclusiones del Dr. Davies
El Dr. Davies sugiere que si los datos son correctos (dado el pequeño tamaño de las muestras), la fisiología del embarazo debe inhibir de algún modo las consecuencias de la estimulación y el crecimiento del cáncer de tiroides. - 43:27 - Debate con preguntas y respuestas
Los doctores Elise Brett y Mark Urken se unen al debate. La Dra. Brett pregunta por qué se debe interrumpir la lactancia 6 semanas antes de someterse a la terapia con yodo radiactivo y pregunta sobre un modelo de riesgo trimestral para la sustitución de la TSH.
8. Evaluación de los nódulos tiroideos durante la infancia1
ATA
Los niños con DTC deben ser atendidos por equipos de médicos con experiencia en el tratamiento del DTC en niños. Esto facilitará la toma de decisiones interdisciplinarias sobre la terapia óptima y ayudará a reducir la posibilidad de que el tratamiento y el seguimiento a largo plazo sean demasiado agresivos o inadecuados
La evaluación y el tratamiento de los nódulos tiroideos en los niños deben ser los mismos que en los adultos, con las excepciones de que:
- Las características de la ecografía y el contexto clínico deben utilizarse, más que el tamaño por sí solo, para identificar los nódulos que justifiquen la realización de una PAAF,
- Todas las PAAF en niños deben realizarse bajo la guía de los Estados Unidos,
- La PAAF preoperatoria de un nódulo hiperfuncionante en un niño no está justificada siempre que se extirpe la lesión,
- Una forma difusamente infiltrativa de PTC puede ocurrir en niños y debe ser considerada en una glándula clínicamente sospechosa, y
- La cirugía (lobectomía más istmectomía) es preferible a la repetición de la PAAF en la mayoría de los nódulos con citología indeterminada.
Una prueba mutacional positiva parece tener una alta probabilidad de estar asociada a la malignidad. Por el contrario, no existen datos suficientes en niños para confiar en los estudios genéticos negativos para excluir de forma fiable la malignidad. Aunque los estudios moleculares son prometedores para complementar los resultados de la PAAF, en particular para los nódulos que arrojan una citología indeterminada, aún no han sido suficientemente validados en niños y no pueden recomendarse en la práctica clínica habitual hasta que se realicen más estudios.
Contenido educativo complementario
Diferencias en la citología de nódulos tiroideos en adultos y en niños
Presentador: Ari Wassner, MD
Resumen
El Dr. Ari Wassner y el Dr. Andrew Bauer explican las diferencias entre el tratamiento de los nódulos tiroideos en adultos y en niños y sugieren técnicas para mejorar la precisión predictiva a la hora de determinar la malignidad de los nódulos en los niños.
- El Dr. Ari Wassner presenta un artículo que analiza las diferencias en la citología de los nódulos tiroideos y el riesgo de malignidad entre niños y adultos.
- El objetivo de la evaluación de los nódulos tiroideos es detectar los cánceres de tiroides clínicamente significativos y guiar el manejo óptimo de esos nódulos
- La discusión del Dr. Wassner se centra específicamente en las diferentes citologías de los nódulos tiroideos según el sistema de clasificación Bethesda y las diversas estrategias de gestión recomendadas para cada clase.
- Históricamente, la evaluación de los nódulos tiroideos se realizaba mucho menos en los niños en comparación con los adultos. Esto se debía a que las tasas de malignidad en los niños alcanzaban hasta 70%, promoviendo así la noción de que todos los nódulos tiroideos en los niños son probablemente cancerosos y deben ser resecados sin necesidad de una biopsia confirmatoria.
- Cuando las biopsias comenzaron a realizarse de forma más consistente en los niños, el proceso de manejo fue variable entre las instituciones hasta que se publicaron las Directrices oficiales de manejo de 2015 para niños con nódulos tiroideos y cáncer diferenciado de tiroides en 2015. Estas directrices estimularon el aumento de la recopilación de datos pediátricos.
- Con un flujo de trabajo citopatológico consistente ahora establecido, el Dr. Wassner evaluó si las tasas de malignidad en niños y adultos son similares dentro de las categorías citológicas de Bethesda.
- Los resultados mostraron que las tasas de malignidad eran insignificantemente diferentes entre adultos y niños cuando se consideraban los nódulos originalmente considerados sospechosos y malignos. Sin embargo, en las categorías indeterminadas de AUS y neoplasia folicular, las tasas de malignidad pediátricas fueron significativamente mayores.
- La realización de biopsias por aspiración con aguja fina de repetición de citologías atípicas en niños alteró el plan de tratamiento 50% de las veces. Por lo tanto, merece la pena realizar una PAAF repetida en niños con citologías indeterminadas, como el síndrome de la inmunodeficiencia adquirida y la neoplasia folicular.
- El Dr. Bauer complementó los hallazgos del Dr. Wassner con una discusión sobre cuándo realizar biopsias de FNA y cómo mejorar la precisión y fiabilidad de los resultados utilizando el análisis molecular.
- Al comparar las directrices de puntuación de la ATA para los nódulos tiroideos en adultos con el sistema pediátrico TI-RADS, parece que los extremos del sistema de puntuación TI-RADS son indicadores precisos de malignidad o de falta de ella. Sin embargo, los nódulos indeterminados siguen siendo difíciles de evaluar tanto con la PAAF como con la ecografía. Además, el tamaño del nódulo no debe utilizarse para estratificar a los pacientes pediátricos.
- El Dr. Bauer sugiere que las pruebas moleculares oncogénicas son la respuesta a la pregunta de qué método de diagnóstico puede diferenciar mejor las categorías indeterminadas. La presencia de un driver oncogénico aumenta la precisión en el diagnóstico. El valor predictivo positivo de malignidad se correlacionó con el nivel de controladores oncogénicos, con la excepción de RAS, que en realidad aumentó la tasa de llamada benigna. Estos datos deben ampliarse de forma prospectiva.
Prevalencia y factores de riesgo de la multifocalidad en el cáncer de tiroides pediátrico
Presentadores: Drs. Grace Banik, Maisie Shindo y Gary Francis
Resumen
El Dr. Banik y el Dr. Shindo presentan su excelente estudio multicéntrico para determinar los predictores críticos de la enfermedad multifocal en niños con cáncer de tiroides.
- El Dr. Banik comienza con una visión general del cáncer de tiroides pediátrico. El CTP pediátrico es una entidad única con características patológicas, moleculares y oncológicas distintas a las de los adultos. Los niños tienden a presentar una enfermedad más avanzada (3:31).
- La enfermedad multifocal en uno o más lóbulos tiende a ser más común en los niños que en los adultos. Este es un factor importante que hay que tener en cuenta en las decisiones de gestión relativas al CPT pediátrico (4:31).
- Recientemente, ha habido un renovado interés en los enfoques conservadores para el manejo del CPT pediátrico. De hecho, la lobectomía todavía puede considerarse en niños con CTP pequeños y solitarios (6:03).
- Dicho esto, la noción de cirugía conservadora sigue siendo objeto de debate. Por lo tanto, los intentos del Dr. Banik y del Dr. Shindo por dilucidar aún más la prevalencia y los factores de riesgo de la enfermedad multifocal en el CPT pediátrico (7:15).
- Los predictores significativos de la enfermedad multifocal fueron los estadios bilaterales N1b, M1 y T3, así como los niños menores de 10 años (11:44).
- Los predictores significativos de enfermedad bilateral fueron los estadios NN1b y T3, así como los niños menores de 10 años (12:53).
- En definitiva, el estudio del Dr. Banik aclara y refuerza el papel de la multifocalidad dentro del esquema general de la toma de decisiones quirúrgicas en niños con cáncer de tiroides.
- El Dr. Francis ofrece su opinión experta sobre el estudio y profundiza en el tema del cáncer de tiroides pediátrico (20:45).
- Basándose en los hallazgos de este estudio y en otros anteriores, el Dr. Francis concluye que la enfermedad bilateral es común en las series pediátricas y se predice más por la edad, la radiación previa, los síndromes cancerígenos predisponentes, las imágenes preoperatorias, la metástasis, la estadificación N, la extensión extratiroidea y la invasión linfovascular (30:49).
- Además, el Dr. Francis propone una serie de consideraciones que de otro modo sólo justificarían una lobectomía en pacientes pediátricos (31:31).
- Se necesita más investigación molecular para determinar cómo el comportamiento multifocal del cáncer de tiroides pediátrico difiere del de los adultos. Esto es particularmente importante para considerar la posibilidad de un manejo quirúrgico demasiado agresivo de la enfermedad multifocal en los niños (44:03).

Añada los próximos seminarios de TIROxMDS a su calendario
En 2 rápidos pasos, puede añadir hoy mismo todo nuestro programa de próximos seminarios a su calendario. De este modo, recibirá notificaciones de las próximas conferencias, presentaciones y estudios de casos. Todos los viernes a las 8:00 AM EST, cubrimos un nuevo tema de la investigación publicada.
Añadir al calendarioPróximos seminarios web

Referencias
- 1.Haugen B, Alexander E, Bible K, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Tiroides. 2016;26(1):1-133. doi:10.1089/thy.2015.0020
- 2.Ito Y, Onoda N, Okamoto T. The revised clinical practice guidelines on the management of thyroid tumors by the Japan Associations of Endocrine Surgeons: Preguntas básicas y recomendaciones para el tratamiento del cáncer de tiroides. Endocr J. 2020;67(7):669-717. doi:10.1507/endocrj.EJ20-0025
- 3.Gharib H, Papini E, Garber JR, et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi Medical Guidelines for Clinical Practice for the Diagnosis and Management of Thyroid Nodules - 2016 Update Appendix. Práctica de Endocrinología. Publicado en línea en mayo de 2016:1-60. doi:10.4158/ep161208.gl
- 4.Filetti S, Durante C, Hartl D, et al. Cáncer de tiroides: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2019;30(12):1856-1883. doi:10.1093/annonc/mdz400
- 5.Haddad RI, Nasr C, Bischoff L, et al. Guías de la NCCN Insights: Thyroid Carcinoma, Version 2.2018. J Natl Compr Canc Netw. Publicado en línea en diciembre de 2018:1429-1440. doi:10.6004/jnccn.2018.0089
- 6.Tessler FN, Middleton WD, Grant EG, et al. ACR Thyroid Imaging, Reporting and Data System (TI-RADS): White Paper of the ACR TI-RADS Committee. Revista del Colegio Americano de Radiología. Publicado en línea en mayo de 2017:587-595. doi:10.1016/j.jacr.2017.01.046
- 7.Alexander E, Pearce E, Brent G, et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Tiroides. 2017;27(3):315-389. doi:10.1089/thy.2016.0457