Estadificación inicial y respuesta a la terapia
Esquema clínico
= Primers en tiroidología
= Presentación del Journal Club
= Discusión basada en casos (incluyendo mesas redondas)
= Conferencias de Gran Ronda
1. Estadificación inicial y evaluación de la respuesta al tratamiento
A. El proceso de estadificación de un paciente
ATA // AAES // ESMO // JAES // NCCN
- Las recomendaciones para el tratamiento del cáncer de tiroides deben basarse en las evaluaciones de riesgo específicas del paciente.1-5
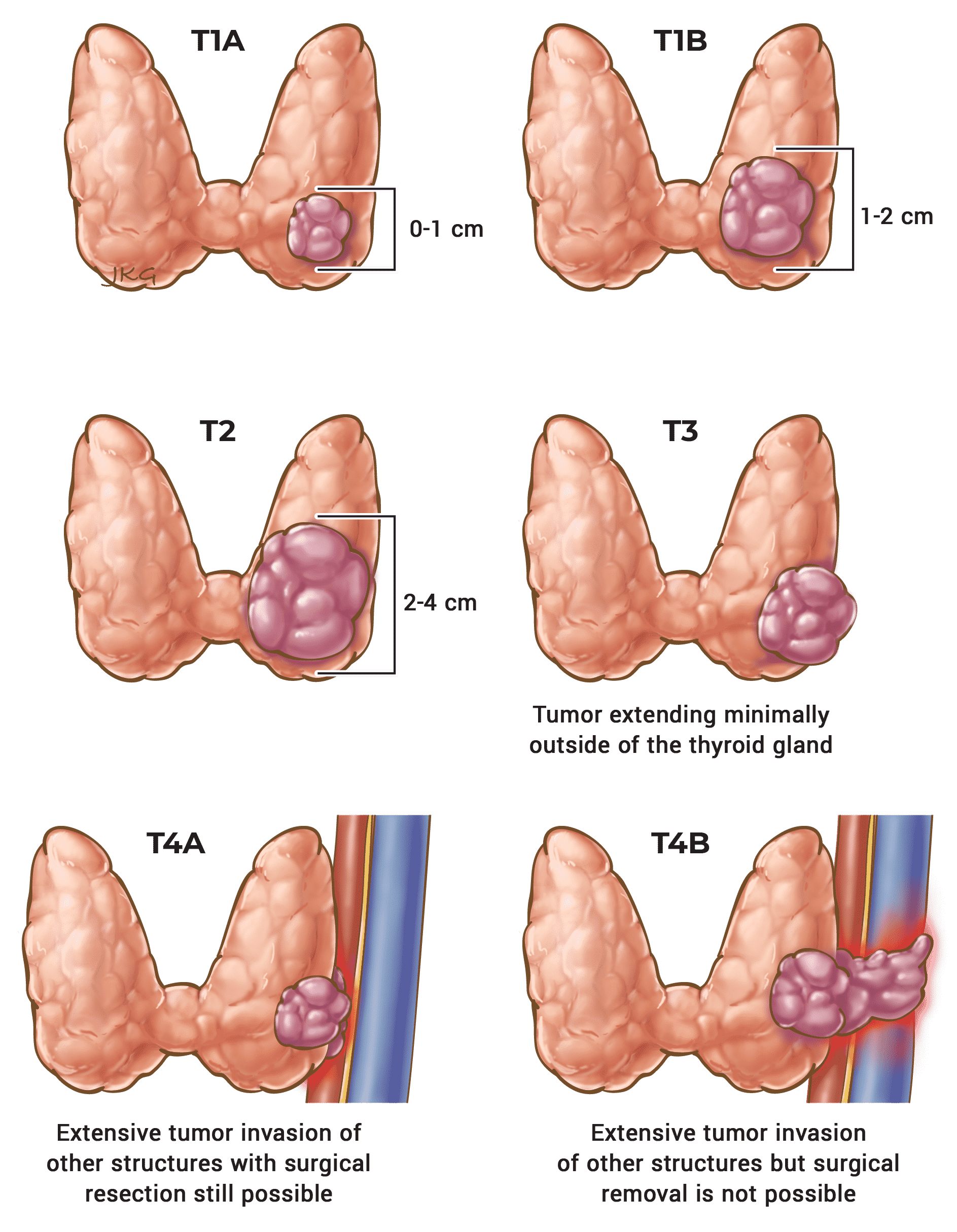
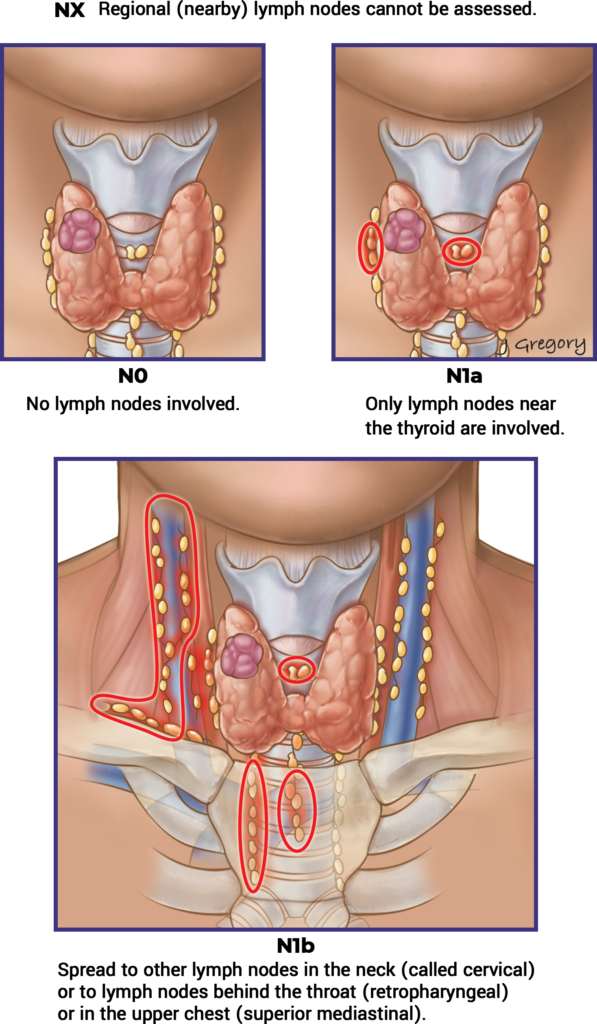
- Se recomienda el sistema de estadificación TNM de la AJCC/UICC para la predicción de mortalidad específica por enfermedad.1-5
Tablas y figuras
Tabla 5. Estadificación AJCC del cáncer diferenciado de tiroides (mortalidad específica de la enfermedad)
Edad en el momento del diagnóstico
Menor de 55 años
| T | N | M | Escenario Grupo |
|---|---|---|---|
| Cualquier T | Cualquier N | M0 | I |
| Cualquier T | Cualquier N | M1 | II |
55 años o más
| T | N | M | Escenario Grupo |
|---|---|---|---|
| T1 | N0 / NX | M0 | I |
| T1 | N1 | M0 | II |
| T2 | N0 / NX | M0 | I |
| T2 | N1 | M0 | II |
| T3a / T3b | Cualquier N | M0 | II |
| T4a | Cualquier N | M0 | III |
| T4b | Cualquier N | M0 | IV A |
| Cualquier T | Cualquier N | M1 | IV B |
- Un sistema de estratificación del riesgo en tres niveles (bajo, intermedio o alto)1-3,5 o un sistema de estratificación del riesgo en cuatro niveles (muy bajo, bajo, intermedio o alto)4 se recomienda para predecir el riesgo de tener una enfermedad persistente o recurrente.
Tablas y figuras
Tabla 11. Sistema de estratificación del riesgo con modificaciones propuestas (ATA 2009)
Nivel de riesgo
ATA Riesgo bajo
- Cáncer de tiroides papilar (con todo lo siguiente):
- No hay metástasis locales ni a distancia,
- Se ha resecado todo el tumor macroscópico,
- No hay invasión tumoral de los tejidos o estructuras loco-regionales,
- El tumor no tiene una histología agresiva (por ejemplo, célula alta, variante hobnail, carcinoma de células columnares),
- Si yo131 se da, no hay focos metastásicos ávidos de RAI fuera del lecho tiroideo en el primer escáner de RAI de cuerpo entero posterior al tratamiento,
- No hay invasión vascular,
- N0 clínico o ≤ 5 micrometástasis N1 patológicas (< 0,2 cm en su dimensión mayor).*
- Variante tiroidea folicular encapsulada e intratiroidea del cáncer papilar de tiroides.*
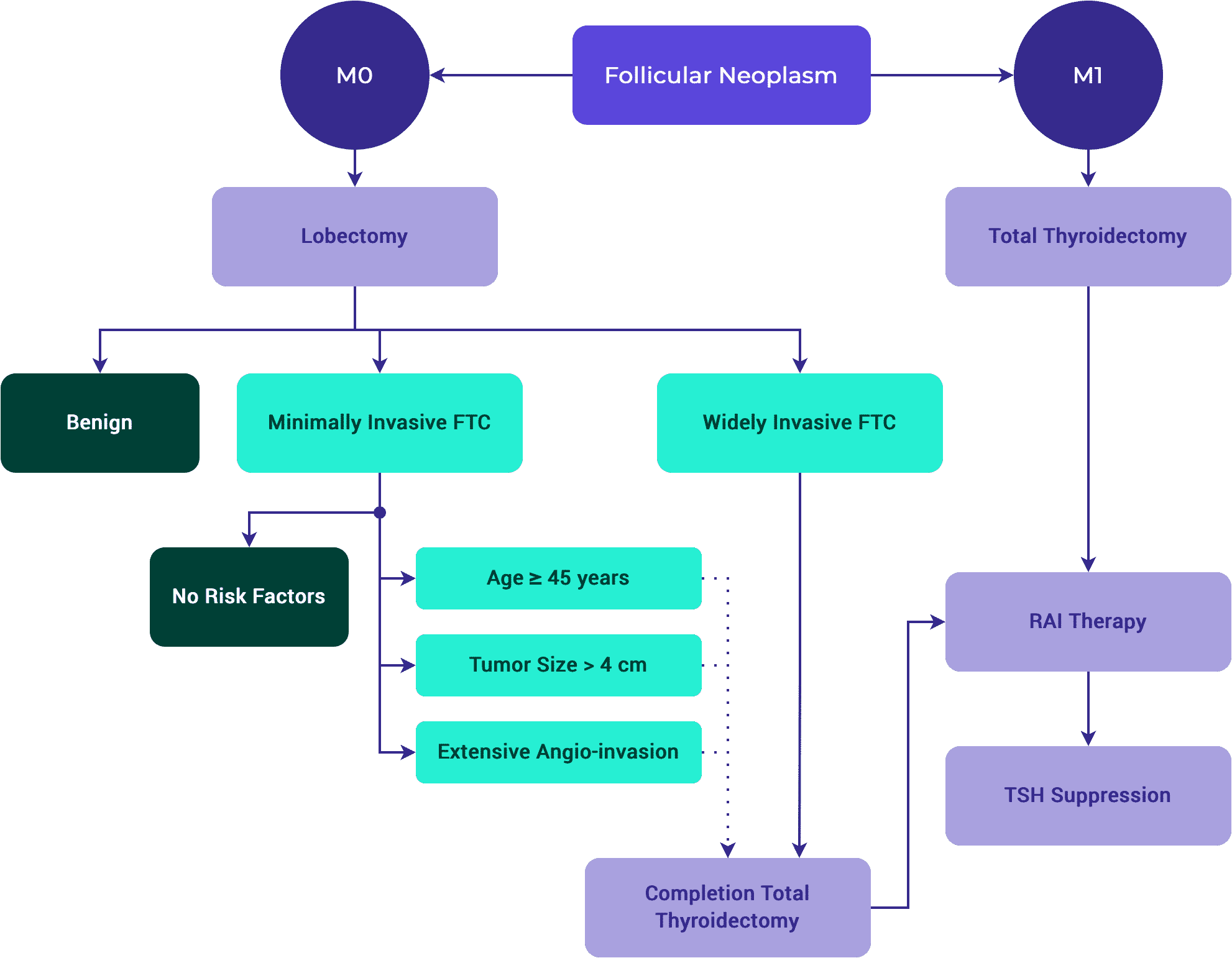
- Cáncer folicular de tiroides intrateracional, bien diferenciado, con invasión capsular y sin invasión vascular o con una invasión mínima (< 4 focos).*
- Microcarcinoma papilar intratiroideo, unifocal o multifocal, incluyendo BRAFV600E mutado (si se conoce).*
Riesgo intermedio ATA
- Invasión microscópica del tumor en los tejidos blandos peritiroideos.
- Focos metastásicos en el cuello con RAI en el primer escáner de cuerpo entero después del tratamiento.
- Histología agresiva (por ejemplo, célula alta, variante hobnail, carcinoma de células columnares).
- Cáncer papilar de tiroides con invasión vascular.
- N1 clínico o > 5 N1 patológico con todos los ganglios linfáticos implicados < 3 cm en su dimensión mayor.*
- Microcarcinoma papilar multifocal con ETE y BRAFV600E mutado (si se conoce).*
ATA Alto Riesgo
- Invasión macroscópica del tumor en los tejidos blandos peritiroideos (ETE bruto).
- Resección tumoral incompleta.
- Metástasis a distancia.
- Tiroglobulina sérica postoperatoria sugestiva de metástasis a distancia.
- N1 patológico con cualquier ganglio linfático metastásico ≥ 3 cm en su mayor dimensión.*
- Cáncer folicular de tiroides con invasión vascular extensa (> 4 focos de invasión vascular).*
Figura 11. Espectro ATA de riesgo de recurrencia

- Reconociendo que el riesgo de recurrencias de la enfermedad estructural se considera mejor como un continuo que como categorías de riesgo discretas, se recomienda el uso de variables pronósticas adicionales para refinar aún más las estimaciones de riesgo individuales.1-5
Factores asociados al aumento del riesgo de recurrencia de la enfermedad1-5- Edad en el momento del diagnóstico. Las tasas de recurrencia son más altas en los extremos de la edad.
- Aumento del tamaño del tumor primario.
- Aumento del tamaño de las metástasis en los ganglios linfáticos cervicales.
- Aumento del número de metástasis en los ganglios linfáticos cervicales.
- Extensión extranodal en las metástasis de los ganglios linfáticos.
- Aumento de la extensión de la invasión vascular. Más de 4 focos.
- Histología potencialmente más agresiva. Por ejemplo, la variante de células altas del cáncer papilar de tiroides, la variante esclerosante difusa del cáncer papilar de tiroides, el carcinoma de células de Hürthle y el cáncer de tiroides mal diferenciado.
- Perfil mutacional potencialmente agresivo. Por ejemplo, BRAFV600E + TERT mutación del promotor, o RAS + TERT mutación del promotor.
- Tiroglobulina postoperatoria anormal al menos 4-6 semanas después de la cirugía de tiroides.
- Hallazgos anormales en el diagnóstico postoperatorio o yodo post-radioactivo (I131) terapia de todo el cuerpo (si se hace).
Contenido educativo complementario
Límite de edad óptimo para el sistema de estadificación TNM de la UICC/AJCC
Presentador: Dr. Evert van Velsen
Resumen
El Dr. Evert van Velsen presenta un artículo titulado "Finding the optimal age cutoff for the UICC/AJCC TNM staging system in patients with papillary or follicular thyroid cancer". El Dr. Erik Verburg se une como el Discutidor Invitado Destacado.
- El Dr. Evert van Velsen compara la octava edición del UICC/AJCC TNM (tumor, ganglio, metástasis) con la séptima edición. (2:55) Una de las principales diferencias entre la 7ª y la 8ª edición es que el límite de edad se ha cambiado de 45 a 55 años. Esto se basó en los hallazgos de tres estudios anteriores que demostraron que un límite de edad de 55 años conducía a una mejor predicción de la supervivencia específica de la enfermedad (DSS) en pacientes con cáncer de tiroides diferenciado. Sin embargo, estos estudios se basaron en la 7ª edición de la estadificación TNM de la UICC/AJCC, y no en la 8ª edición actualizada.
El objetivo de este estudio era doble:
- Investigar el límite de edad óptimo para el sistema de estadificación TNM para predecir la DSS utilizando el sistema de estadificación TNM de la 8ª edición de la UICC/AJCC.
- Evaluar si los límites de edad óptimos para el cáncer folicular de tiroides (FTC) y el cáncer papilar de tiroides (PTC) difieren.
- Este estudio concluyó que cuando se utilizan incrementos de cinco años, 50 años es el límite de edad óptimo para el cáncer de tiroides diferenciado (DTC) y el PTC, pero 40 años es el límite de edad óptimo para el FTC. Cuando se utilizan incrementos de un año, 50 años es el límite de edad óptimo para el CTD, 48 años es el límite de edad óptimo para el CPT y 41 años es el límite de edad óptimo para el CTF.
Conclusiones adicionales aportadas por este estudio:
- Los puntos de corte basados en la edad mejoran el poder pronóstico del sistema de estadificación TNM. Sin embargo, se desconoce si un corte de edad dicotómico es la forma óptima de incorporar la edad a estos sistemas de clasificación.
- La PTC y la FTC deben ser puestas en escena por separado.
- El Dr. Erik Verburg habla de las importantes lecciones que pueden extraerse de las grandes bases de datos. (21:50)
- El Dr. Verburg resume la finalidad de los sistemas de estadificación. Los sistemas de estadificación clasifican a los pacientes individuales en categorías de riesgo discretas, lo que nos permite determinar qué línea de tratamiento es la más adecuada para el paciente. (23:20)
- El Dr. Verburg describe los retos asociados a la comparación de diferentes sistemas de estadificación, destacando la variedad de metodologías utilizadas y la falta de consenso sobre cómo hacerlo. (27:14)
- Observar el seguimiento a largo plazo de los pacientes es importante a la hora de comparar los modelos de estadificación e identificar los efectos sutiles.
- El Dr. van Velsen ofrece posibles explicaciones sobre el papel que puede desempeñar la edad en las diferencias biológicas inherentes al carcinoma papilar y folicular de tiroides. (45:21)
Definición del cáncer de tiroides avanzado y su tratamiento específico
Presentador: Dr. David C. Shonka, Jr.
Resumen
- 3:40 - Tratamiento de las mutaciones causantes
El Dr. Shonka explica cómo las mutaciones impulsoras se asocian a subtipos específicos de cáncer de tiroides y cómo pueden tratarse. - 9:09 - Elaborar una declaración
El Dr. Shonka explica cómo se elaboró la declaración de consenso por un equipo multidisciplinar de panelistas que votaron varias declaraciones relacionadas con el tratamiento del cáncer de tiroides avanzado. - 13:28 - El proceso de pruebas mutacionales
El Dr. Shonka presenta las cifras del documento que resumen cómo los panelistas creen que deben enfocarse las pruebas mutacionales para el cáncer diferenciado de tiroides avanzado. - 16:14 - Pruebas mutacionales para subtipos de cáncer de tiroides
El Dr. Shonka resume las recomendaciones para las pruebas mutacionales en el tratamiento del carcinoma medular de tiroides y el carcinoma anaplásico de tiroides. - 19:05 - Implicaciones clínicas
El Dr. Shonka concluye con una visión general de las opciones de terapia sistémica dirigida, las repercusiones prácticas y las conclusiones del estudio. - 21:17 - Estudio de caso
El Dr. Shonka presenta un caso ilustrativo para demostrar cómo las pruebas mutacionales pueden cambiar la forma en que los proveedores gestionan el tratamiento del cáncer de tiroides avanzado.
Variación en el diagnóstico de la neoplasia tiroidea folicular no invasiva con características nucleares de tipo papilar (NIFTP)
Presentadora: Dra. Debbie Chen
Resumen
- 9:25 - Criterios diagnósticos revisados para el NIFTP
El Dr. Chen habla de un estudio reciente de Nikiforov et al. en el que se proponen criterios diagnósticos más estrictos para la neoplasia folicular tiroidea no invasiva con características nucleares similares a las papilares (NIFTP). Este estudio llevó a la Asociación Norteamericana de Registros Centrales de Cáncer (NAACCR) a modificar su esquema de codificación. La EFVPTC no invasiva se reclasificó como NIFTP. - 13:27 - Tendencias de la tasa de incidencia de la CT
El Dr. Chen presenta las tendencias en las tasas de incidencia del cáncer de tiroides por subtipos y NIFTP. De muchas tendencias notables, podemos ver que hubo un aumento estadísticamente significativo en la incidencia de PTC general. - 24:21 - Tumores multifocales
El Dr. Baloch detalla cómo la presencia de un segundo tumor en la glándula tiroides no cambia el diagnóstico de NIFTP.
Trabajo en curso - Un enfoque computacional para evaluar la altura en el carcinoma papilar de tiroides
Presentadores: Dra. Margaret Brandwein-Weber y Dr. Scott Doyle
Resumen
- 7:41 - Variante de células altas (TCV) como factor de mal pronóstico
El Dr. Brandwein habla de estudios anteriores en los que se utilizó el análisis multivariante para investigar los resultados asociados a la VTC. - 13:04 - Presentación del estudio
La Dra. Brandwein presenta su estudio sobre el VTC en el carcinoma papilar primario de tiroides (CPT), destacando la metodología y los resultados. - 20:44 - Evaluar la aptitud con sistemas informáticos
El Dr. Brandwein explica cómo pueden utilizarse funciones matemáticas y programas informáticos para evaluar la estatura con mayor precisión que con el método tradicional del "globo ocular". - 32:57 - Cuantificar la capacidad
El Dr. Doyle explica los principios y el marco conceptual en los que se basa el entrenamiento de sistemas de inteligencia artificial (IA) para cuantificar la estatura. - 38:20 - Entrenamiento del clasificador de IA
El Dr. Doyle explica cómo se utilizó la anotación patológica de diapositivas de pacientes para crear "mosaicos" para entrenar el clasificador de IA.
Desafíos en la cirugía del cáncer de tiroides: Presentación de un caso ante un panel de líderes internacionales
Moderador: Dr. Mark L. Urken
Panelistas: Dres. Gregory Randolph, Joseph Scharpf, Ashok Shaha y Mark Zafereo
Resumen
- 12:33 - Gestión del funcionamiento del RLN cuando el cáncer está "implicado"
El Dr. Urken presenta el proceso de toma de decisiones al observar la adherencia de un nervio en un ganglio linfático. El Dr. Shaha explica hasta qué punto llegará para preservar la función de este nervio y explica que no sacrificaría el nervio. El Dr. Randolph explica que la resección del nervio no es una consideración para este paciente en términos de recurrencia o supervivencia global. Este nervio debe disecarse con criterio para asegurarse de que está invadido. - 24:05 - Valor de la sección congelada en cirugía
El Dr. Urken presenta un caso de masa tiroidea derecha y cuerda vocal derecha paralizada. Las imágenes preoperatorias sugerían una lesión de alto grado. En este caso, el Dr. Scharpf explica cómo utilizaría la sección congelada para orientar el alcance de la cirugía. También se puede obtener información pronóstica y terapéutica del análisis de la sección congelada. - 30:21 - Gestión de enfermedades recurrentes
El Dr. Urken inicia el debate sobre el tema de la extirpación de la enfermedad ganglionar recurrente para una mujer de 33 años que se sometió a una tiroidectomía total en una institución externa con ganglios positivos. Para el Dr. Scharpf, el hallazgo previo de ENE no influye necesariamente en las decisiones. Para el Dr. Zafereo, la cirugía y la vigilancia son las dos únicas opciones para tratar a esta paciente. El Dr. Zafereo también sugiere una inspección más detallada de las imágenes. - 42:25 - Terapia neoadyuvante en la enfermedad BRAFv600e
En este caso, el Dr. Zafereo describe cómo procedería para comprender mejor la histopatología del paciente. Sugiere un inhibidor de BRAF para esta paciente. El Dr. Randolph también sugiere probar un enfoque neoadyuvante.
Contenido educativo complementario
Tabla 7. Alteraciones genéticas e histología
Fenotipo
Adenoma tóxico
Mutación genética somática conocida / Alteraciones
- TSH-R
- GNAS
Nódulos tiroideos benignos
Mutación genética somática conocida / Alteraciones
- N-, H- y K-RAS
- EIF1AX
Tumor folicular no invasivo con características similares a las del papiloma (NIFTP)
Mutación genética somática conocida / Alteraciones
- N-, H- y K-RAS
- BRAF K601E
Carcinoma papilar de tiroides infiltrativo (FVPTC)
Mutación genética somática conocida / Alteraciones
- N-, H- y K-RAS
- BRAF V600E
Carcinoma papilar de tiroides (CPT)
Mutación genética somática conocida / Alteraciones
- RET/PTC
- BRAF V600E
- N-, H-, K-RAS
- TERT
Célula columnar, célula alta, variante de PTC Hobnail
Mutación genética somática conocida / Alteraciones
- BRAF V600E
Variante de PTC difuso-escleroso
Mutación genética somática conocida / Alteraciones
- RET/PTC
Carcinoma folicular de tiroides (FTC)
Mutación genética somática conocida / Alteraciones
- N-, H- y K-RAS
- PAX8/PPAR
- PTEN
Carcinoma de células de Hürthle
Mutación genética somática conocida / Alteraciones
- NRAS
- Genes de la vía PI3K-Akt
Carcinoma de tiroides pobremente diferenciado (PDTC)
Mutación genética somática conocida / Alteraciones
- N-RAS (Insular)
- BRAF V600E
- PIK3CA
- RET/PTC
- TERT
Carcinoma anaplásico de tiroides (ATC)
Mutación genética somática conocida / Alteraciones
- N-RAS, BRAF V600E
- PIK3CA
- TP53
- β-catenina
- EIF1AX
Carcinoma medular de tiroides (CMT)
Mutación genética somática conocida / Alteraciones
- RET (Mutación de la línea germinal en el MTC heredado, mutación somática)
- N-, H- y K-RAS (mutaciones somáticas)
Adaptado con permiso de Wolters Kluwer Health, Inc: el autor o los autores, los títulos de los artículos, el título de la revista, el número del volumen, el número del número, las páginas incluidas y la URL del sitio web de la página de la revista.
Tabla 8. Subtipos histológicos de PTC
Subtipo
Variante folicular
| ¿Presencia de las características nucleares de la PTC? |
| Sí |
| Características |
| - Mutación RAS más común. - Patrón de crecimiento folicular. |
| Pronóstico |
| 10 años DSS 93% |
Encapsulado con variante folicular, invasivo
| ¿Presencia de las características nucleares de la PTC? |
| - |
| Características |
| - La mutación RAS o el reordenamiento PPARG son más comunes. - Baja tasa de LNM. |
| Pronóstico |
| DSS de 10 años ~100% |
Variante folicular No encapsulada / Infiltrativa
| ¿Presencia de las características nucleares de la PTC? |
| - |
| Características |
| BRAF V600E más común. |
| Pronóstico |
| Equivalente a la PTC clásica/convencional |
Célula columnar
| ¿Presencia de las características nucleares de la PTC? |
| No |
| Características |
| - Papilas revestidas por células columnares con estratificación nuclear. - Los tumores grandes con invasión capsular se asocian a LNM y DM. |
| Pronóstico |
| Variable |
Morular cribiforme
| ¿Presencia de las características nucleares de la PTC? |
| Ocasionalmente |
| Características |
| - Presencia de áreas morulo-esquemáticas con inclusiones intranucleares y aclaramiento nuclear. - Asociado al síndrome de poliposis adenomatosa familiar. |
| Pronóstico |
| Equivalente a la PTC clásica/convencional |
Clásico / Convencional
| ¿Presencia de las características nucleares de la PTC? |
| Sí |
| Características |
| LNM Común |
| Pronóstico |
| - 5 años DSS 97.4% - 10 años DSS 93% |
Esclerosante difuso
| ¿Presencia de las características nucleares de la PTC? |
| Sí |
| Características |
| - Fibrosis difusa. - Infiltración linfoide densa. - Metaplasia escamosa. |
| Pronóstico |
| - 5 años DSS 96% - Equivalente al PTC de alto riesgo |
Celda alta
| ¿Presencia de las características nucleares de la PTC? |
| Sí |
| Características |
| - Posible extensión extratiroidea y LNM. - > Las células 30% son dos veces más altas que anchas y tienen un citoplasma eosinófilo. |
| Pronóstico |
| 5 años DSS 95.6% |
Hobnail
| ¿Presencia de las características nucleares de la PTC? |
| Sí |
| Características |
| - Mayor riesgo de DM. - > 30% tienen rasgos de caracol (núcleos excéntricos y citoplasma cónico). - Agrupaciones sinciciales o micropapilares con núcleos colocados apicalmente. - BRAF V600E o p53 positivo |
| Pronóstico |
| 5 años DSS 83% |
Adaptado con permiso de Wolters Kluwer Health, Inc.: el autor o los autores, los títulos de los artículos, el título de la revista, el número del volumen, el número del número, las páginas incluidas y la URL del sitio web de la página de la revista.
- El menor riesgo de recidiva se asocia al cáncer de tiroides papilar clásico:
- ≤ 1 cm.
- Confinado a la tiroides.
- Sin metástasis en los ganglios linfáticos clínicamente aparentes.
- Las estimaciones de riesgo iniciales deben modificarse continuamente durante el seguimiento a medida que se acumulan datos adicionales.1,3,5
- Un método para facilitar la evaluación continua del riesgo consiste en clasificar a los pacientes en cada seguimiento en función de su respuesta a la terapia como si tuvieran un:1,5
- Excelente respuesta. No hay evidencia clínica, bioquímica o estructural de la enfermedad.
- Respuesta bioquímica incompleta. Tg anormal o aumento de anticuerpos anti-Tg en ausencia de enfermedad localizable.
- Respuesta estructural incompleta. Metástasis loco-regionales o a distancia persistentes o recientemente identificadas.
- Respuesta indeterminada. Hallazgos bioquímicos o estructurales no específicos que no pueden clasificarse con seguridad como benignos o malignos, incluidos los pacientes con anticuerpos anti-Tg estables o en disminución sin evidencia estructural definitiva de enfermedad.
Tablas y figuras
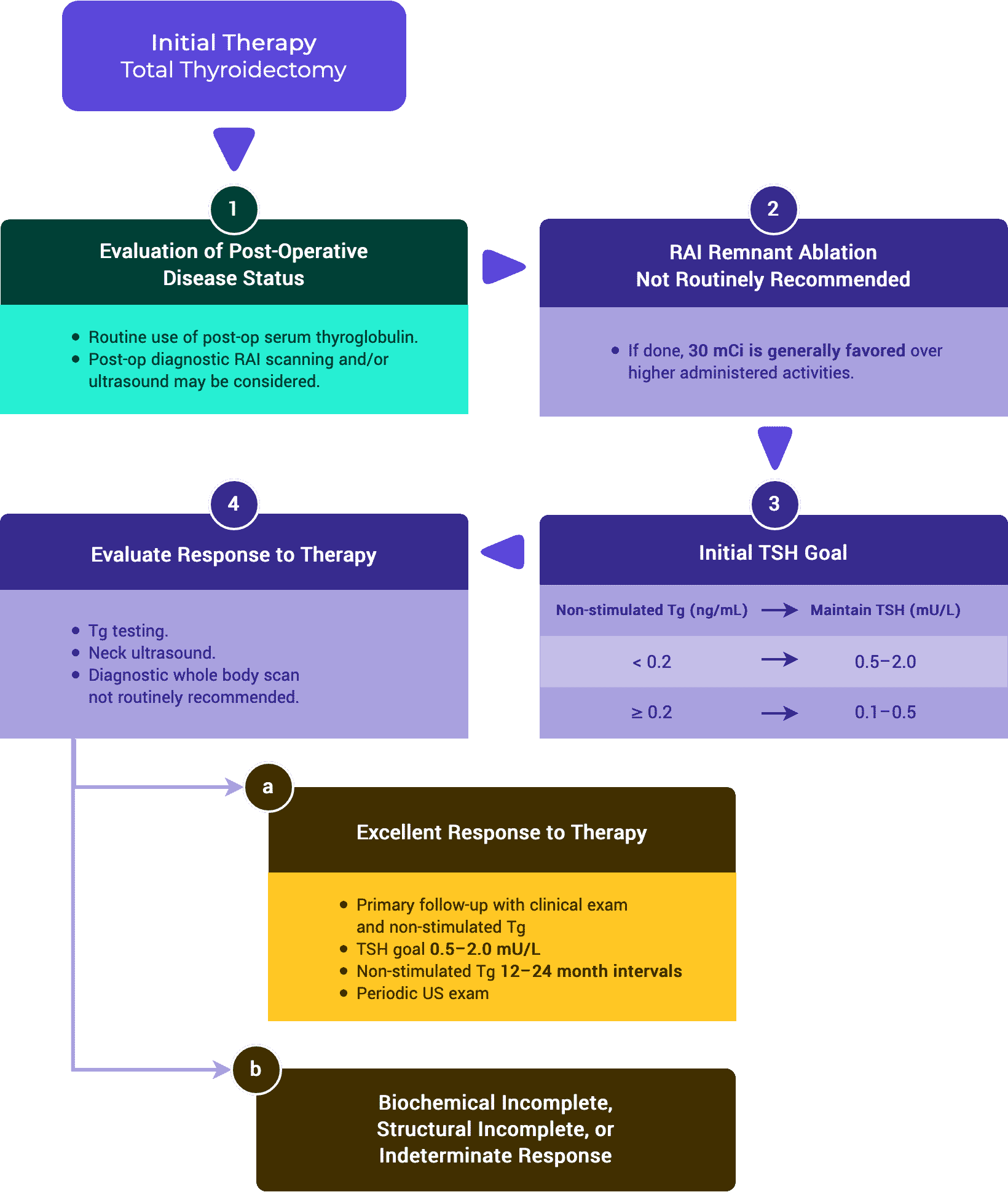
Cuadro 2a. Respuesta al tratamiento: Tiroidectomía total y RRA (ATA vs. ESMO)
Respuesta al tratamiento
Excelente
| Imágenes |
| No hay hallazgos relevantes en las imágenes. |
| Tg con supresión de TSH |
| < 0,2 ng/mL |
| TSH-Stim TG |
| < 1 ng/mL |
| TgAB |
| - No especificado (ATA) - Indetectable (ESMO) |
Bioquímica Incompleta
| Imágenes |
| No hay hallazgos relevantes en las imágenes. |
| Tg con supresión de TSH |
| 1 ng/mL |
| TSH-Stim TG |
| 10 ng/mL |
| TgAB |
| Aumento de los niveles de TgAB |
Incompleto estructuralmente
| Imágenes |
| Evidencia de enfermedad estructural o funcional. * |
| Tg con supresión de TSH |
| * |
| TSH-Stim TG |
| * |
| TgAB |
| * |
Indeterminado
| Imágenes |
| Hallazgos inespecíficos en US/CT. - O - Débil captación en el lecho tiroideo en la exploración con RAI. |
| Tg con supresión de TSH |
| - Tg detectable, pero < 1 ng/mL (ATA) - 0,2-1 ng/mL (ESMO) |
| TSH-Stim TG |
| - Tg estimulada detectable, pero < 10 ng/mL (ATA) - 1-10 ng/mL (ESMO) |
| TgAB |
| Niveles de TgAB estables o en descenso en ausencia de enfermedad estructural o funcional. |
* Independientemente de los niveles de Tg o TgAB.
Tabla 2b. Respuesta al tratamiento: Tiroidectomía total sola
Respuesta al tratamiento
Excelente
| Imágenes |
| No hay hallazgos relevantes en las imágenes. |
| Tg con supresión de TSH |
| < 0,2 ng/mL |
| TSH-Stim TG |
| No especificado |
| TgAB |
| Indetectable |
Bioquímica Incompleta
| Imágenes |
| No hay hallazgos relevantes en las imágenes. |
| Tg con supresión de TSH |
| Tg > 5 ng/mL - O - Valores de Tg en aumento con niveles de TSH similares. |
| TSH-Stim TG |
| - |
| TgAB |
| Aumento de los niveles de TgAB |
Incompleto estructuralmente
| Imágenes |
| Evidencia de enfermedad estructural o funcional. * |
| Tg con supresión de TSH |
| * |
| TSH-Stim TG |
| * |
| TgAB |
| * |
Indeterminado
| Imágenes |
| Hallazgos inespecíficos en US/CT. - O - Débil captación en el lecho tiroideo en la exploración con RAI. |
| Tg con supresión de TSH |
| < 0,2-5 ng/mL |
| TSH-Stim TG |
| No especificado |
| TgAB |
| Niveles de TgAB estables o en descenso en ausencia de enfermedad estructural o funcional. |
* Independientemente de los niveles de Tg o TgAB.
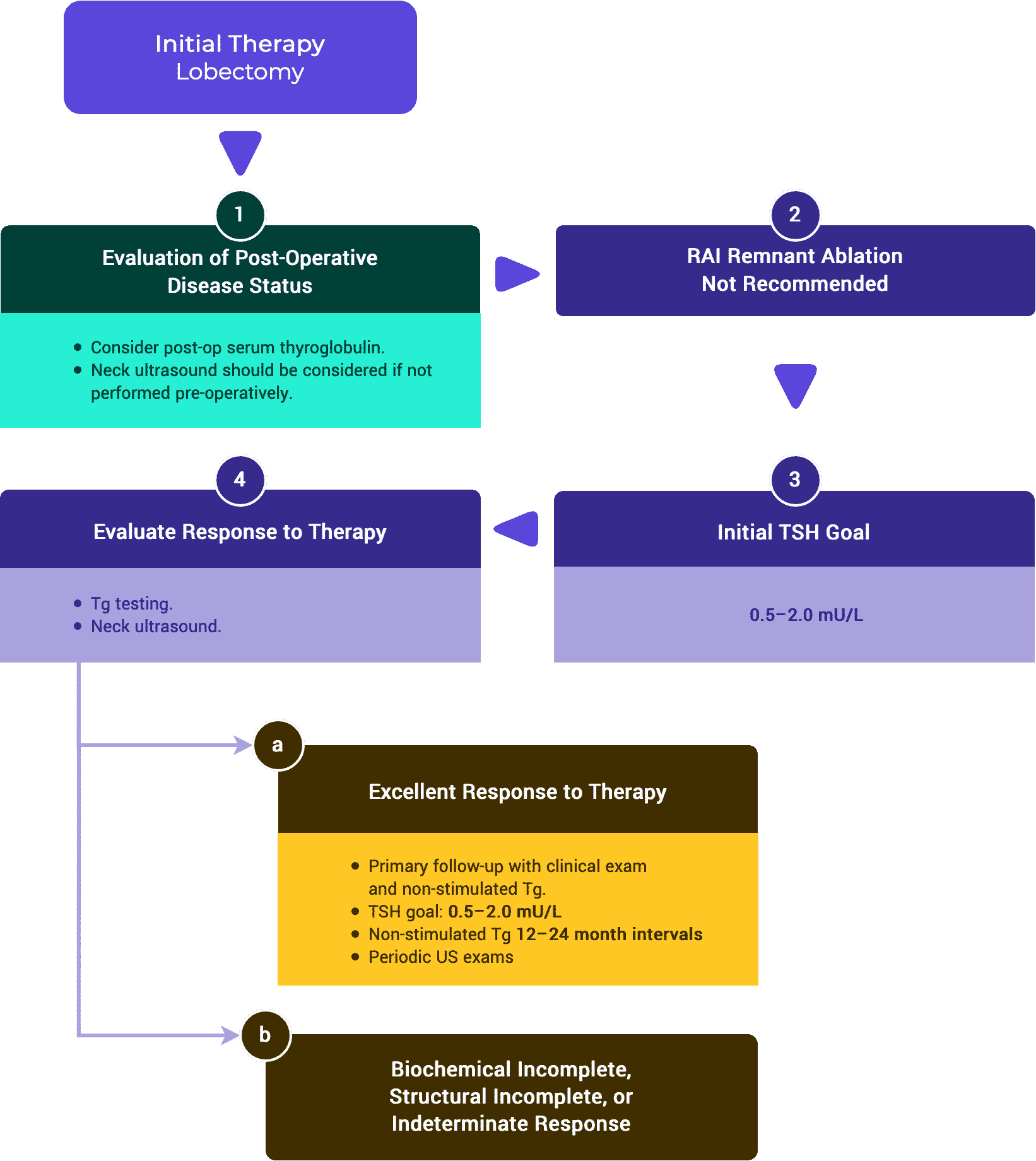
Cuadro 2c. Respuesta al tratamiento: Lobectomía sola
Respuesta al tratamiento
Excelente
| Imágenes |
| No hay hallazgos relevantes en las imágenes. |
| Tg con supresión de TSH |
| Estable |
| TSH-Stim TG |
| Estable |
| TgAB |
| Indetectable |
Bioquímica Incompleta
| Imágenes |
| No hay hallazgos relevantes en las imágenes. |
| Tg con supresión de TSH |
| Aumento de los valores de Tg con niveles similares de TSH |
| TSH-Stim TG |
| TgAB |
| Subiendo |
Incompleto estructuralmente
| Imágenes |
| Evidencia de enfermedad estructural o funcional. * |
| Tg con supresión de TSH |
| * |
| TSH-Stim TG |
| * |
| TgAB |
| * |
Indeterminado
| Imágenes |
| Hallazgos inespecíficos en US/CT. |
| Tg con supresión de TSH |
| * |
| TSH-Stim TG |
| * |
| TgAB |
| * |
* Independientemente de los niveles de Tg o TgAB.
Contenido educativo complementario
Variabilidad interobservador en la evaluación histopatológica de la extensión extratiroidea del carcinoma de tiroides bien diferenciado
Presentadores: Juan Hernandez-Parra, MD & Dominick Guerrero, MD
Comentario: Dra. Margaret Brandwein-Weber
Estudio
- 11 patólogos expertos revisaron 69 diapositivas escaneadas elegidas para la posible controversia con la extensión mínima extratiroidea (mETE).
- Se encontró una significativa variabilidad interobservador en la evaluación histopatológica de la ETE.
Conclusión:
- La identificación microscópica de la ETE es subjetiva, sobre todo si se tiene en cuenta únicamente el tejido adiposo, la vasculatura o los nervios en lugar del músculo esquelético.
- Complejidad debida en parte a las propiedades histológicas, anatómicas y de desarrollo únicas del tiroides.
Aplicado al AJCC 8ª edición
Según los autores, los resultados apoyan los criterios relativamente estrictos de ETE incluidos en la 8ª edición del Manual de Estadificación del Cáncer de la AJCC.
- "Puede disminuir la variabilidad interobservador"
- Permite una mayor coherencia en el diagnóstico y la estadificación del carcinoma de tiroides.
Mientras que la variabilidad interobservador se resuelve por la 8ª AJCC, esto pone en duda muchos estudios que examinan el impacto de la ETE.
Impacto de la 8ª edición del AJCC
- Resuelve la variabilidad interobservador, hasta cierto punto.
- Aumento de la necesidad de mejorar la comunicación entre cirujanos y patólogos.
- Creó una desconexión con las directrices de la ATA.
Controversia restante
- Ni el AJCC ni el CAP ofrecen orientación si no se reconocen las mETE multifocales extensas de forma grosera.
- La mETE se asocia a una biología agresiva; se asocia a la ENE, a los ganglios linfáticos positivos y a la clasificación de ganglios linfáticos agresivos ATA.
Rendimiento en el mundo real de las estimaciones de riesgo de la Asociación Americana de Tiroides para predecir los resultados del cáncer diferenciado de tiroides a un año
Presentadores: Cosimo Durante, MD, PhD
Un estudio multicéntrico prospectivo de 2000 pacientes
El Dr. Cosimo Durante y la Dra. Amanda La Greca discuten el sistema de clasificación de riesgo de la Asociación Americana de Tiroides como una herramienta para diferenciar los riesgos de la enfermedad recurrente y para disminuir el sobrediagnóstico y el sobretratamiento de los pacientes con cáncer de tiroides.
- Antes del estudio del Dr. Durante, la eficacia del sistema de estratificación del riesgo de la ATA de 2015 aún no se había probado en el mundo real (15:21)
- Este estudio demostró que el sistema de clasificación de riesgo ATA funciona y es un predictor significativo en la respuesta al tratamiento en el seguimiento de 1 año para los pacientes con cáncer diferenciado de tiroides
- La Dra. Amanda La Greca habla del concepto de "silla rota" que se produce cuando se proporciona una información inadecuada al paciente en la visita inicial (40:03)
- El Dr. La Greca hace hincapié en la importancia de distinguir y diagnosticar los cánceres de tiroides agresivos que requieren esfuerzos terapéuticos intensos y una estrecha vigilancia después del tratamiento (46:42)
Un estudio de cohortes retrospectivo con validación de predictores de resultados de cáncer diferenciado de tiroides
Presentadores: Dra. Ayanthi Wijewardene
- 4:30: Estratificación de pacientes de muy bajo riesgo
El Dr. Wijewardene explica por qué las actuales directrices de estratificación del riesgo de la ATA no identifican adecuadamente a los pacientes de muy bajo riesgo que podrían no necesitar tratamiento con yodo radiactivo (RAI). - 8:00: Revisión de un modelo de riesgo
La Dra. Wijewardene explica cómo ella y su equipo identificaron las variables asociadas a la metástasis o la recidiva y desarrollaron un modelo de riesgo predictivo que incorpora esos factores. - 12:47: Basándose en las directrices de la ATA
La Dra. WIjewardene resume los resultados y conclusiones de su estudio, enfatizando cómo su Modelo Predictivo de Riesgo propuesto identificó más pacientes con metástasis sincrónicas o recurrencia en comparación con el sistema de estratificación de riesgo ATA.
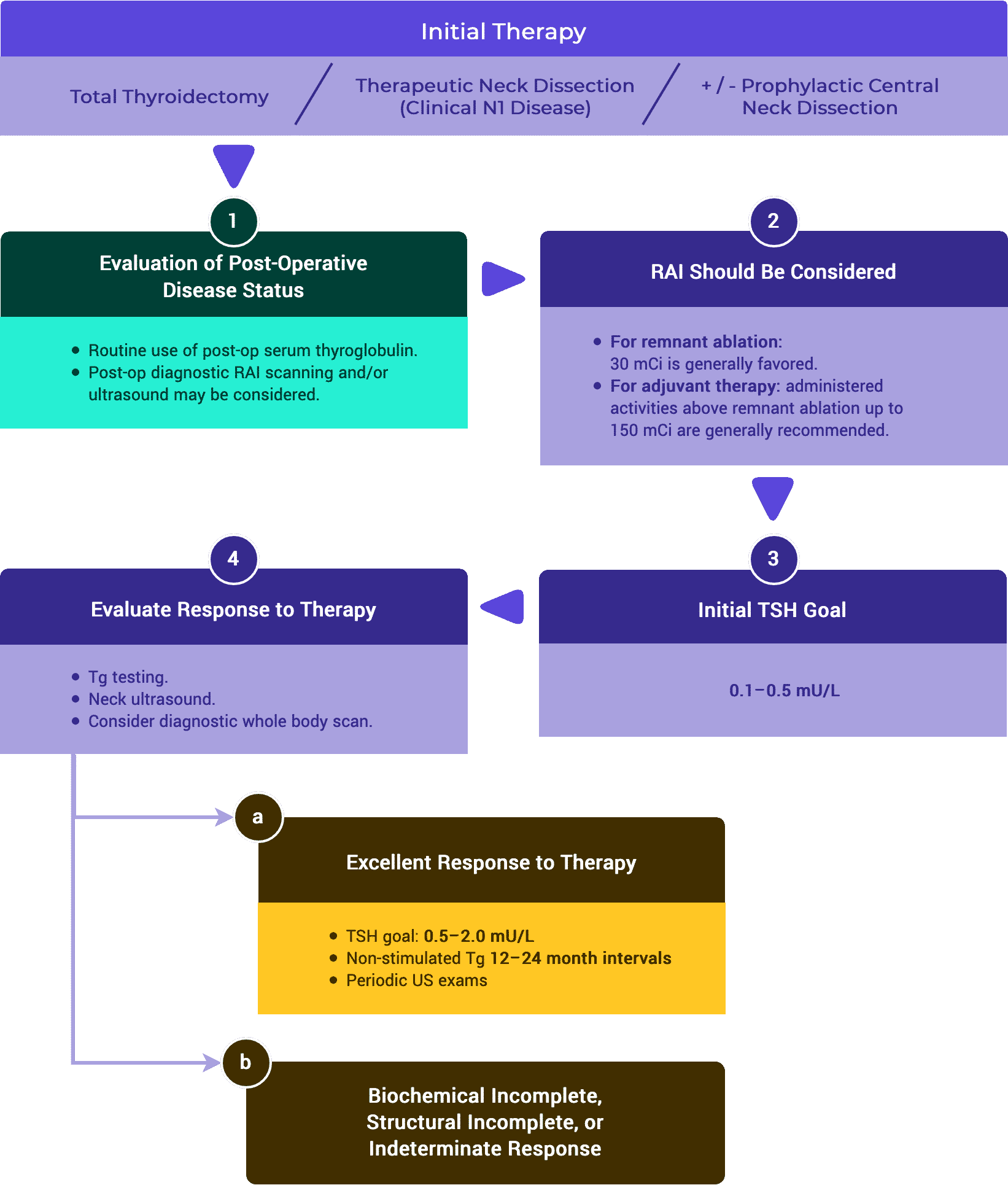
2. Recomendaciones de seguimiento una vez establecida la respuesta a la terapia
A. Excelente respuesta a la terapia
ATA // ESMO // NCCN
En los pacientes de riesgo bajo e intermedio, una excelente respuesta al tratamiento debería conducir a una disminución temprana de la intensidad y la frecuencia del seguimiento y del grado de supresión de la TSH.1,3,5
Contenido educativo complementario
Evaluación dinámica del riesgo en pacientes con cáncer diferenciado de tiroides
Presentador: Fabián Pitoia, MD
El Dr. Fabián Pitoia y el Dr. Iwao Sugitani discuten el papel crítico de la evaluación dinámica del riesgo en la toma de decisiones para el cuidado del cáncer diferenciado de tiroides.
Resumen
El Dr. Fabián Pitoia presenta el concepto de la "silla rota" en relación con los pacientes con cáncer diferenciado de tiroides, destacando que no siempre se tiene información completa sobre el riesgo inicial de recurrencia cuando falta una de las "patas". Estas "patas" incluyen:
- Información sobre el procedimiento quirúrgico
- Informe patológico detallado
- Estudios de imagen fiables
- Pruebas de laboratorio fiables
El Dr. Fabián Pitoia explica que se pasa de una "silla rota" a una "silla reparada" cuando se tiene acceso a las respuestas al tratamiento. Es el cambio de la evaluación estática del riesgo a la evaluación dinámica del riesgo.
- Esto ayuda a predecir una probabilidad reducida de SIR.
El Dr. Iwao Sugitani hace hincapié en la importancia de realizar una evaluación del riesgo durante todo el proceso de diagnóstico, cirugía, terapias adyuvantes y seguimiento. Esta evaluación de riesgos incluye:
- Identificación de los pacientes de bajo riesgo que podrían optar a la vigilancia activa y de los pacientes de alto riesgo que requieren un régimen de tratamiento clásico en el período peri-diagnóstico.
- Evaluación del riesgo de mortalidad y del riesgo de recurrencia en el momento de la toma de decisiones iniciales en el tratamiento del CPT, incluyendo la cirugía y las terapias adyuvantes.
- Evaluación de la respuesta a la terapia durante el seguimiento
i. Intervalos de seguimiento
- En los pacientes de riesgo bajo e intermedio de ATA, el intervalo de tiempo entre las mediciones de Tg puede alargarse hasta al menos 12-24 meses.1,3,5
- Independientemente de la respuesta a la terapia inicial, los pacientes de alto riesgo de ATA deben realizarse determinaciones de Tg a intervalos de 6-12 meses durante varios años.1,5
La prueba de Tg estimulada con TSH no se recomienda en pacientes de riesgo bajo e intermedio con una excelente respuesta al tratamiento.1,3,5
Las mediciones de Tg no estimuladas deben considerarse en pacientes tratados con lobectomía o tiroidectomía total sin terapia de yodo radiactivo.1,5
La TSH sérica debe medirse al menos cada 12 meses en todos los pacientes que reciben terapia de hormonas tiroideas.1,3
ii. Objetivos del TSH
- En los pacientes de riesgo bajo e intermedio que demuestran una excelente respuesta al tratamiento, el objetivo de TSH puede estar en el rango de referencia bajo (0,5-2 mU/L).1,3,5
- En los pacientes de alto riesgo con una excelente respuesta al tratamiento, las directrices de la ATA recomiendan mantener la TSH entre 0,1-0,5 mU/L durante un máximo de 5 años, mientras que las directrices de la ESMO recomiendan un objetivo de TSH de 0,5-2 mU/L.1,5
La ecografía de cuello puede realizarse periódicamente en función del riesgo de recidiva del paciente y del estado de la Tg.1,3,5
- Tras la tiroidectomía total y la ablación del remanente de yodo radiactivo, los pacientes de bajo riesgo que logran una respuesta excelente pueden ser seguidos principalmente con un examen clínico.1
- En los pacientes de alto riesgo que logran una excelente respuesta al tratamiento, se puede considerar la vigilancia periódica mediante ecografía del cuello, tomografía computarizada y/o resonancia magnética.1,5
Contenido educativo complementario
Supresión de la tirotropina para el cáncer papilar de tiroides
Presentador: Dra. Maria Papaleontiou
Un estudio de encuestas a médicos
Las doctoras Maria Papaleontiou y Angela Leung discuten el espectro de recomendaciones médicas para el uso de la supresión de la hormona estimulante del tiroides (TSH) en pacientes con cáncer papilar de tiroides (PTC) en el contexto de un estudio y la literatura en general.
La Dra. Maria Papaleontiou presenta los resultados de un estudio que pretendía evaluar las recomendaciones de los médicos con respecto al uso de la supresión de la TSH después del tratamiento inicial en pacientes con PTC de diferentes grados de riesgo:
- Señaló que los médicos que atienden a un mayor número de pacientes con cáncer de tiroides eran menos propensos a recomendar la supresión de la TSH en escenarios de bajo y muy bajo riesgo.
La Dra. Maria Papaleontiou subraya que, dados los riesgos y los mínimos beneficios que la supresión de la TSH presenta para los pacientes con PTC de bajo y muy bajo riesgo, son necesarias iniciativas educativas dirigidas a los médicos de bajo volumen para reducir el sobretratamiento en este ámbito.
La Dra. Angela Leung ofrece una visión general de los resultados relacionados con el uso de la supresión de la TSH en la literatura, llamando la atención sobre los resultados inconsistentes y la necesidad de realizar más estudios prospectivos.
Al hablar del uso de la supresión de la TSH en pacientes de edad avanzada, la Dra. Angela Leung señala que la TSH sérica en individuos de edad avanzada aumenta de forma natural con el tiempo.
iii. Diagnóstico por escáner de cuerpo entero
- En los pacientes de bajo riesgo o de riesgo intermedio que logran una excelente respuesta a la terapia, no se recomiendan las exploraciones rutinarias con yodo radiactivo de cuerpo entero.1,3,5
- En los casos de alto riesgo de ATA o en los de riesgo intermedio con características de mayor riesgo, puede ser útil una gammagrafía de yodo radiactivo de cuerpo entero.1,3
B. Respuesta indeterminada a la terapia
ATA // ESMO // NCCN
La Tg sérica en tratamiento con tiroxina debe medirse cada 6-12 meses. Las mediciones de Tg más frecuentes pueden ser apropiadas para los pacientes de alto riesgo de ATA.1,3,5
i. Objetivos de la TSH
- Por lo general, se recomienda mantener la terapia de hormonas tiroideas a un nivel para lograr niveles séricos de TSH en un rango de 0,1-0,5 mU/L durante un máximo de 5 años.1,5
- En los pacientes clasificados inicialmente como de bajo riesgo de recidiva, la TSH sérica puede situarse en el rango de referencia bajo (0,5-2 mU/L).1
- Después de cinco años, el grado de supresión de la TSH puede ser reconsiderado y potencialmente reducido con una estrecha vigilancia.1
La ecografía cervical debe realizarse cada 6-12 meses.1,5
En pacientes con hallazgos anormales o indeterminados en la ecografía, se puede considerar la realización de exploraciones de cuerpo entero con radioyodo estimulado con TSH junto con la medición de Tg y anticuerpos Tg.3
En los pacientes con Tg sérica elevada o anticuerpos Tg en aumento con o sin imágenes RAI negativas, debe considerarse la posibilidad de realizar una TC de tórax y/o una TEP-18 FDG.1,3,5
Las estimaciones del riesgo de recurrencia deben reevaluarse y modificarse durante el seguimiento.1,5
Los hallazgos inespecíficos que se vuelven sospechosos con el tiempo o el aumento de los niveles de Tg o de anticuerpos anti-Tg pueden evaluarse más a fondo con imágenes adicionales o con una biopsia cuando sea factible.1
Si un resultado positivo cambiara el manejo, los ganglios linfáticos ecográficamente sospechosos ≥ 8-10 mm en el diámetro más pequeño deben ser biopsiados para citología con medición de Tg en el líquido de lavado de la aguja.1
Los ganglios linfáticos sospechosos < 8-10 mm en el diámetro más pequeño pueden ser seguidos sin biopsia, considerando la posibilidad de realizar una PAAF o una intervención si hay crecimiento o si el ganglio amenaza estructuras vitales.1
C. Respuesta bioquímica incompleta a la terapia
ATA // ESMO // NCCN
El seguimiento debe realizarse al menos cada 6-12 meses durante varios años, y luego periódicamente según el riesgo del paciente y el estado de la Tg.1,3,5
La TSH sérica debe mantenerse entre 0,1 y 0,5 mU/L, teniendo en cuenta la clasificación inicial de riesgo de ATA, el nivel de Tg, la tendencia de la Tg a lo largo del tiempo y los riesgos asociados a la supresión de la TSH.1,5
La ecografía de cuello es la principal herramienta de vigilancia para identificar la recidiva del lecho tumoral o la enfermedad de los ganglios linfáticos.1,3,5
La prueba de Tg estimulada (tras la retirada de la TSH humana recombinante o de la hormona tiroidea) puede considerarse en pacientes con una respuesta bioquímica incompleta tras terapias adicionales o un descenso espontáneo de la Tg a lo largo del tiempo con el fin de reevaluar la respuesta al tratamiento.1
Evaluación funcional con imágenes RAI estimuladas por TSH con I123 (preferible porque evita el aturdimiento) o de baja actividad (2-5 mCi o 74-185 MBq) I131 con SPECT/CT puede realizarse para determinar la idoneidad de la terapia con RAI.1,3,5
La PET/TC con F-18 FDG (con o sin estimulación de TSH) puede realizarse especialmente en pacientes con imágenes negativas de RAI, pero también en pacientes con sospecha de enfermedad desdiferenciada que pueden tener focos neoplásicos sin captación de RAI. Las lesiones positivas a la FDG PET se asocian a un peor pronóstico y a una enfermedad refractaria a la RAI.1,3,5
Si hay que realizar una evaluación estructural adicional, se puede recurrir a la TC con contraste yodado o a la RMN. El TAC torácico se realiza para el diagnóstico de metástasis pulmonares y/o mediastínicas. La RM cerebral, el estudio del esqueleto por RM y el abdomen por RM o TAC pueden ser necesarios si los pacientes tienen síntomas referibles a estos órganos o antes de la terapia con RAI y tienen riesgo de complicaciones por la inflamación del tumor. Si se administra contraste yodado, es necesario aplazar la evaluación de la RAI durante 6-8 semanas.1,5
El aumento de la Tg o la TgAb indica la necesidad de realizar pruebas de imagen y considerar una terapia adicional. 1,2,3
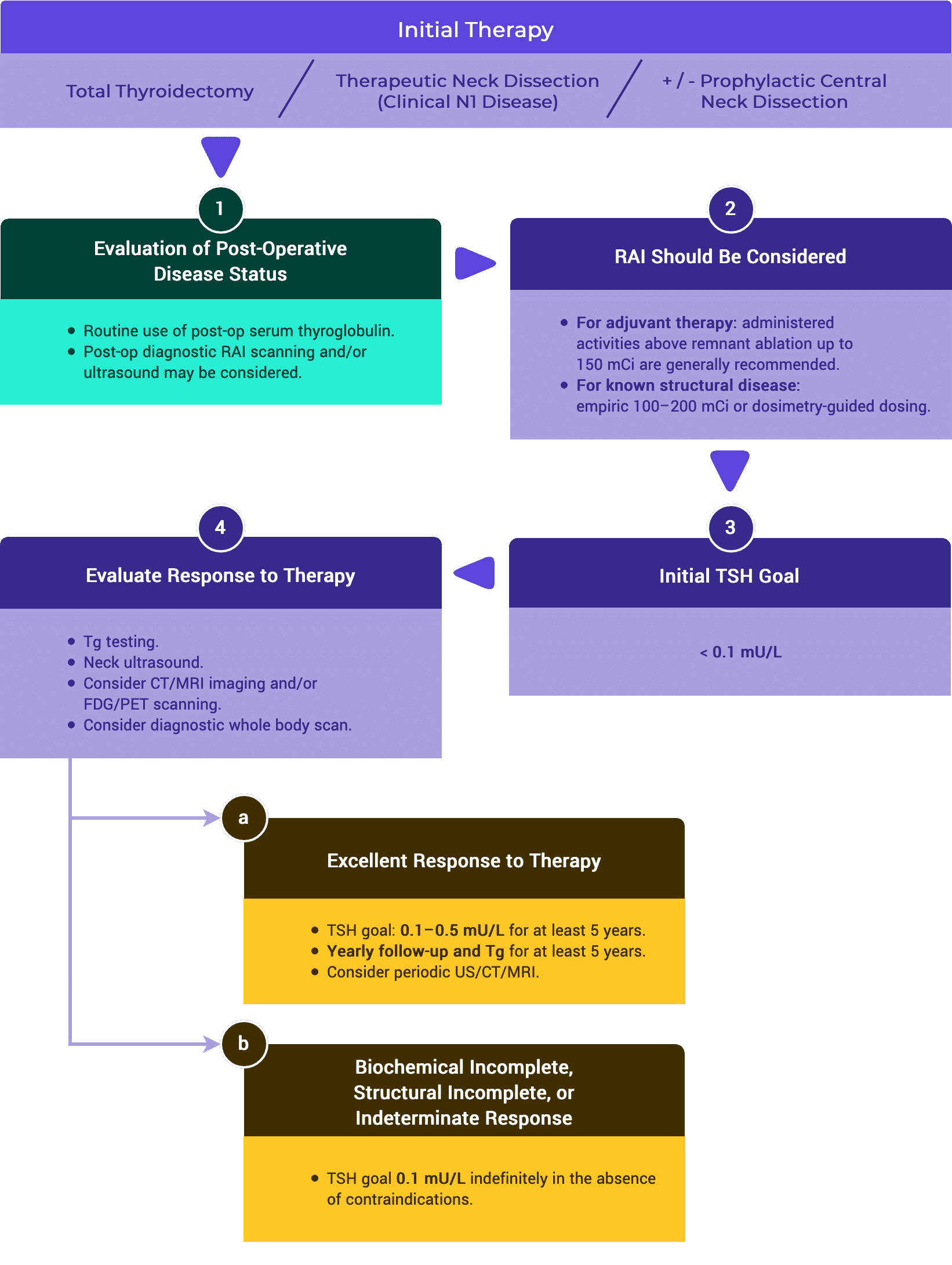
D. Respuesta estructural incompleta a la terapia
ATA // ESMO // JAES // NCCN
Por lo general, se recomienda un control en serie cada 6 meses o menos.1,3-5
Los pacientes con enfermedad estructuralmente recurrente o persistente deben recibir una terapia supresora de TSH con un objetivo < 0,1 mIU/L.1,3
La identificación de la enfermedad estructural recurrente o persistente (respuesta incompleta) se confirma más comúnmente a través de los hallazgos de imágenes anormales con la posterior USg-FNA. Puede haber ocasiones en las que la USg-FNA no sea posible o no sea necesaria.1-4
Si un resultado positivo cambiara el manejo, los ganglios linfáticos ecográficamente sospechosos ≥ 8-10 mm en el diámetro más pequeño deben ser biopsiados para citología con medición de Tg en el líquido de lavado de la aguja.1
Los ganglios linfáticos sospechosos < 8-10 mm en el diámetro más pequeño pueden ser seguidos sin biopsia, considerando la posibilidad de realizar una PAAF o una intervención si hay crecimiento o si el ganglio amenaza estructuras vitales.1
La enfermedad estructural persistente o recurrente que se sigue de forma conservadora debe ser controlada mediante evaluaciones periódicas regulares utilizando:
- evaluación clínica,
- imágenes (principalmente ultrasonidos), y
- medición de tiroglobulina y anticuerpos de tiroglobulina.1,3-5
Tablas y figuras
Contenido educativo complementario
El papel de la tiroglobulina y los anticuerpos contra la tiroglobulina
Presentador: Eyal Robenshtok, MD
El Dr. Robenshtok y el Dr. Tuttle discuten la fiabilidad de la tiroglobulina y los anticuerpos de tiroglobulina en la predicción de las medidas de resultados a largo plazo después de la cirugía de lobectomía tiroidea.
Resumen
- El Dr. Robenshtok habla de su estudio de investigación centrado en el umbral estándar de tiroglobulina -30 nanogramos/mililitro- para determinar el rango normal y el valor pronóstico de la tiroglobulina tras una lobectomía.
- La cohorte demostró unos niveles de tiroglobulina prometedores un año después de la cirugía. La media de tiroglobulina era de 12,1 ng/ml, muy por debajo del umbral superior de actividad saludable.
- Tampoco hubo correlación entre los niveles de tiroglobulina y el sexo/edad del paciente.
- Para evaluar el valor pronóstico de la tiroglobulina, se analizó la tasa de recidivas. Si bien el grupo recurrente tenía una media de niveles de tiroglobulina más alta al cabo de un año en comparación con el grupo no recurrente, las desviaciones estándar de ambos llevaban a un solapamiento significativo. Por lo tanto, es imposible utilizar los niveles de tiroglobulina para discernir qué paciente tendría una recidiva al cabo de un año.
- Además, la dinámica de los anticuerpos de tiroglobulina tampoco fue predictiva de la tasa de recurrencia. Esto es válido para ambos subgrupos de pacientes: tiroiditis de Hashimoto y lobectomía contralateral.
- El Dr. Tuttle verificó estos hallazgos con su propia experiencia e investigación, afirmando que el uso de los niveles de tiroglobulina como un marcador individual independiente tiene poca especificidad y poca sensibilidad en el marco de una lobectomía. Dicho esto, no debe descartarse totalmente y debe considerarse cuando las cifras están muy por encima del umbral.
Tratamiento de pacientes con cáncer de tiroides tras lobectomía
Presentadora: Dra. Jennifer Perkins
Resumen
- 4:13 - Elección del abordaje quirúrgico Consideraciones
El Dr. Perkins ofrece una visión general de los factores clínicos que influyen en la decisión de elegir entre lobectomía o tiroidectomía total. - 7:25 - Aumento del nivel de tiroglobulina
El Dr. Perkins presenta el caso de una mujer de 68 años con un nódulo tiroideo izquierdo detectado incidentalmente en una ecografía carotídea. Esta paciente se sometió a una hemitiroidectomía izquierda y presentó un aumento de los niveles de tiroglobulina cinco años después de la cirugía. El Dr. Perkins presenta otros estudios para examinar si la tiroglobulina postlobectomía es fiable. - 16:30 - Tiroidectomía completa
El Dr. Perkins presenta el caso de una mujer de 35 años con un nódulo tiroideo palpable en la exploración física. La PAAF reveló un cáncer papilar de tiroides de 1,9 cm, variante de células altas. El Dr. Perkins evalúa si esta paciente debe someterse a una tiroidectomía completa y, en caso afirmativo, si debe recibir una ablación con yodo radiactivo. - 23:36 - Invasión vascular
El Dr. Perkins comparte el caso de una mujer de 54 años que se sometió a una lobectomía derecha. Como esta paciente presentaba dos vasos de invasión vascular, el Dr. Perkins examina el impacto de la invasión vascular y la invasión capsular. - 36:26 - Debate con preguntas y respuestas

Añada los próximos seminarios de TIROxMDS a su calendario
En 2 rápidos pasos, puede añadir hoy mismo todo nuestro programa de próximos seminarios a su calendario. De este modo, recibirá notificaciones de las próximas conferencias, presentaciones y estudios de casos. Todos los viernes a las 8:00 AM EST, cubrimos un nuevo tema de la investigación publicada.
Añadir al calendario
Referencias
- 1.Haugen B, Alexander E, Bible K, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Tiroides. 2016;26(1):1-133. doi:10.1089/thy.2015.0020
- 2.Patel K, Yip L, Lubitz C, et al. Executive Summary of the American Association of Endocrine Surgeons Guidelines for the Definitive Surgical Management of Thyroid Disease in Adults. Ann Surg. 2020;271(3):399-410. doi:10.1097/SLA.0000000000003735
- 3.Haddad RI, Nasr C, Bischoff L, et al. Guías de la NCCN Insights: Thyroid Carcinoma, Version 2.2018. J Natl Compr Canc Netw. Publicado en línea en diciembre de 2018:1429-1440. doi:10.6004/jnccn.2018.0089
- 4.Ito Y, Onoda N, Okamoto T. The revised clinical practice guidelines on the management of thyroid tumors by the Japan Associations of Endocrine Surgeons: Preguntas básicas y recomendaciones para el tratamiento del cáncer de tiroides. Endocr J. 2020;67(7):669-717. doi:10.1507/endocrj.EJ20-0025
- 5.Filetti S, Durante C, Hartl D, et al. Cáncer de tiroides: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2019;30(12):1856-1883. doi:10.1093/annonc/mdz400